奥咨达提供全方位、一站式的医疗器械临床试验方记录、数据和报告服务:
服务项目:
1.编写临床试验方案
2.临床试验模拟核查和检查
3.医疗器械临床试验研究者手册编写
4.医疗器械临床试验实施数据管理
5.医疗器械临床试验报告编写
6.医疗器械临床试验法规咨询培训
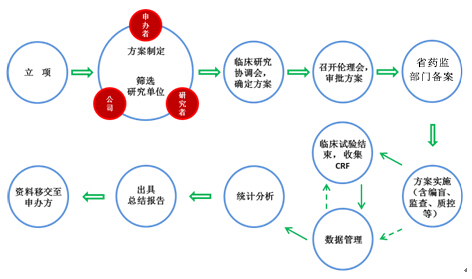
企业在临床试验中,临床基地主要临床试验研究者应当确保将任何观察与发现均正确完整地予以记录,并认真填写病例报告表。我们将协助审核研究者填写的记录是否完善,至少需要包括以下内容:
(一)所使用的试验用医疗器械的信息,包括名称、型号、规格、接收日期、批号或者系列号等;
(二)每个受试者相关的病史以及病情进展等医疗记录、护理记录等;
(三)每个受试者使用试验用医疗器械的记录,包括每次使用的日期、时间、试验用医疗器械的状态等;
(四)记录者的签名以及日期。
作为临床试验的申办者(企业)应当准确、完整地记录与临床试验相关的信息,内容至少包括:
(一)试验用医疗器械运送和处理记录,包括名称、型号、规格、批号或者序列号,接收人的姓名、地址,运送日期,退回维修或者临床试验后医疗器械样品回收与处置日期、原因和处理方法等;
(二)与临床试验机构签订的协议;
(三)监查报告、核查报告;
(四)严重不良事件和可能导致严重不良事件的器械缺陷的记录与报告。
临床试验报告的主要内容包括:
(一)一般信息;
(二)摘要;
(三)简介;
(四)临床试验目的;
(五)临床试验方法;
(六)临床试验内容;
(七)临床一般资料;
(八)试验用医疗器械和对照用医疗器械或者对照诊疗方法;
(九)所采用的统计分析方法以及评价方法;
(十)临床评价标准;
(十一)临床试验的组织结构;
(十二)伦理情况说明;
(十三)临床试验结果;
(十四)临床试验中发现的不良事件以及其处理情况;
(十五)临床试验结果分析、讨论,尤其是适应症、适用范围、禁忌症和注意事项;
(十六)临床试验结论;
(十七)存在问题以及改进建议;
(十八)试验人员名单;
(十九)其他需要说明的情况。
临床试验报告应当由研究者签名、注明日期,经临床试验机构医疗器械临床试验管理部门审核出具意见、注明日期并加盖临床试验机构印章后交申办者。
多中心临床试验中,各分中心临床试验小结应当由该中心的研究者签名并注明日期,经该中心的医疗器械临床试验管理部门审核、注明日期并加盖临床试验机构印章后交牵头单位。
准备好开始了吗?
那就与我们取得联系吧
有一个医疗器械项目想和我们谈谈吗?您可以填写右边的表格,让我们了解您的项目需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632