OLABS ∨
解决方案 ∨
临床试验实践中,在数据分析阶段可能会考虑一个很实际的问题,即需要进行试验目的的转换。通常,这类转换可出现在比较新产品与阳性对照的优效性、非劣效性或等效性试验中,即当试验结果已知时,其结果可能提示另一种解释,如优效性试验设计但只支持非劣效的结论,或非劣效试验设计但还可支持优效的结论,或等效性试验展示出更小的等效性范围。这些试验目的转换时,应考虑哪些因素?本文将针对此问题作出介绍,同时为了简便,以只有一个主要评价指标且是有效性指标的临床试验为例进行解释。
1. 试验目的
优效性试验通常被设计用来发现治疗组间的疗效差异,零假设为治疗组间疗效无差异。分析时可采用显著性检验,一旦统计检验结果提示零假设不成立,估计治疗组间疗效差异大小并判断是否有临床意义则十分重要,因为有统计学意义的疗效差异,并不一定具有临床意义。对于服从正态分布的数据,可通过点估计(治疗组间疗效均值之差)和区间估计来评价组间疗效差异,其应是一个不包含数值0的疗效范围,且显著性检验应与置信区间法等效(见图1)。

图1. 显著性检验与置信区间等效展示图
等效性试验通常被设计用来确认治疗组间不存在有临床意义的疗效差异,一般选取临床上可被接受的最大疗效差异作为等距等效性界值(Δ),此类试验采用置信区间法进行评价会更为直观。假如两种治疗等效,则它们差值的95%CI应完全落在-Δ和+Δ之间(见图2)。如果是生物等效性试验,则一般采用双侧90%CI。

图2. 置信区间法评价等效性试验
非劣效试验通常被设计用来说明新的治疗不差于已有的阳性治疗(也可更有效或疗效相当)。同样,置信区间法是更直观的评价方法,P值则可提供加强非劣效结论的有力支持。此时我们仅关注一侧的疗效差异,因此双侧95%CI应完全落在-Δ的右侧(见图3)。

图3. 置信区间法评价非劣效试验
2. 相关的事先定义
由上述可知,等效性或非劣效试验的结论与Δ的选取密切相关。假如试验结束后再根据试验结果来确定Δ,则总可以找到满足等效或非劣效结论的值。因此需在试验设计时事先对Δ的选取进行定义,并给出合理的理由,同时还应确定CI的范围(一般为双侧95%)。
基于以下几点,我们需事先定义试验到底是优效、等效还是非劣效设计,并且假如需考虑试验目的的转换,对这几点的考虑比对显著性检验和置信区间结果的解释更为重要:
(1) 确保对照治疗、剂量、病人总体及结局指标恰当;
(2) 确保样本量估算基于正确的公式;
(3) 确保等效或非劣效的标准事先定义;
(4) 确保方案中对统计分析的描述恰当;
(5) 确保试验具有足够的敏感性以达到其试验目的。
3. 试验目的转换
3.1 非劣效转优效
假如疗效差异的95%CI不仅完全落在-Δ的右侧,还完全落在数值0的右侧,则显著性检验(0.05显著性水平)的结果可说明试验产品优效于阳性对照(见图4)。此时可计算优效性检验的P值并判断其是否拒绝组间疗效无差异的零假设,并且不存在多重性的问题,因为是在非劣效成立的前提下再检验优效是否成立。当两组治疗安全性差不多时,这一结果展示可完全说明新产品的获益。假如试验组的AE有上升,则应进一步估计疗效差值的大小,以判断其是否足够大,大到可忽略AE的增加。

图4. 非劣效转优效
有许多因素会影响非劣效向优效转换。首先,对照应是有治疗效果的阳性对照。其次,假如试验产品的AE有所增加,应估计额外临床获益的大小,以进行风险-获益分析。还有,针对优效性试验,应基于ITT原则选取FAS进行分析,而PPS分析结果则作为证据支持。而在非劣效试验中,FAS和PPS则同等重要,且结论应一致。最后,良好的试验质量十分重要。临床试验过程中应对试验方案具有很好的依从性。方案违背诸如违反入选排除标准、不依从治疗方案、未按计划访视、结局指标测量方法不当和精度不够等,即使是非系统性或随机的偏离,均会影响试验的敏感性,倾向于得出无差异的结论。通常这些方案偏离的大小并不能被定量,导致试验结果的不可解释。比如两组间疗效无差异可能是由于实施不当,从而两组均无效。因而,非劣效转优效下结论时可信度较高。
当满足如下条件时,非劣效转优效可行:
(1) 试验设计恰当,且严格按照非劣效试验要求实施;
(2) 优效性检验P值支持进行单独的优效评价;
(3) 遵从ITT原则进行统计分析。
3.2 优效转非劣效
假如优效性试验中未能发现组间疗效具有显著性差异,可能会降低目标转而想知道非劣效是否成立。如果优效性试验采用置信区间法进行评价,其95%CI下限可定量估计试验产品与阳性对照疗效差异的最小值。若试验方案中事先定义了非劣效界值-Δ,则降级试验目的在方法学上可行(见图5)。
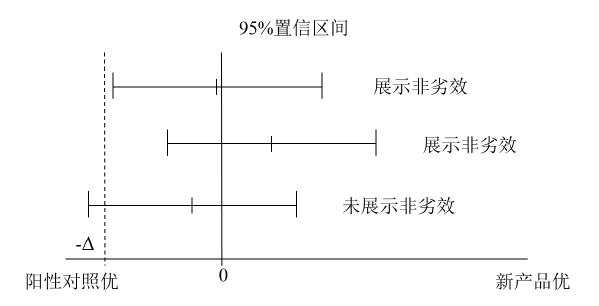
图5. 优效转非劣效
此种情况下,-Δ应在试验设计时事先定义,以防止事后选择界值所带来的麻烦。设计时还应考虑试验是否有足够的敏感性以检出感兴趣的产品疗效。假如没有事先定义-Δ,则需在试验结束后给出界值确定的合理理由,这通常比较难,因为看起来像是试验结果已知后再写下确定界值的依据,无法证明界值选取的客观性。
一些因素会影响优效向非劣效转换。首先,应有证据表明对照具有疗效,且在当前试验中可保持同样的效力。其次,置信区间的下限应可说明非劣效成立,且FAS和PPS结论一致。最后,对试验方案的偏离会导致试验质量不高,从而倾向于得出非劣效的结论。因此,优效转非劣效下结论时可信度较低。我们应注意从以下几点特别展示试验的敏感性:
(1) 有直接或间接证据说明对照已发挥其常规效力;
(2) 对比当前试验与之前展示对照产品有效的试验(病人总体、剂量、结局指标等);
(3) 特别展示不依从水平和病人失访水平,应至少与之前的试验相当;
(4) FAS和PPS结果类似。
当满足如下条件时,优效转非劣效可行:
(1) 非劣效界值在方案中事先定义,或有合理理由(比如有广泛接受的Δ);
(2) ITT原则及PP分析均显示置信区间法和显著性检验P值结论一致;
(3) 试验设计合理,严格按照非劣效试验要求实施;
(4) 试验的敏感度够高,可检出真实存在的疗效差异;
(5) 有直接或间接证据说明对照治疗发挥了常规效力。
3.3 等效界值改变
等效性试验中,有时会关心等效性界值在试验结束后是否可作出修改。假定生物等效性试验中新药生物利用度的90%CI为0.90~1.15,是否只能按事先定义的0.80~1.25来下等效结论?或是可以按0.90~1.15来下等效结论?
一般来说,基于实际数据的更窄置信区间来下结论是可被接受,因为不存在数据驱动界值选取的问题。相反,增大等效性界值则不接受,因为显然界值的改变是为了适应数据的需要。这些考虑同样适用于以95%为置信区间的临床等效性试验和非劣效试验。
4. 讨论
本文仅以只有一个主要评价指标且是有效性指标的临床试验为例。实践中假如试验包含多个主要评价指标,在需要转换试验目的时,应在相应产品开发背景下分别考虑每个指标,并针对每个指标作出优效或非劣效的结论。如需考虑整个试验是否达到优效或非劣效,则应基于该领域的法规要求及指标间的结果模式。转换的考虑要点同样适用于以安全性指标为主要结局指标的情形,但转换不适用于以安慰剂为对照的试验。假如优效和非劣效均是试验的可能结局时,应在设计方案时事先说明本文提到的所有相关考虑。特别地,统计分析应逐步进行,比如先非劣效后优效。
5. 结论
对优效性试验转换为非劣效(或相反情况)的解释,建议采用置信区间法对试验结果进行评价。对于良好设计和实施的试验,假如分析恰当,从非劣效转向优效通常不会有什么问题。但从优效转非劣效则会比较困难,因为可能需要在看到试验结果后给出客观确定界值的合理理由,且非劣效试验存在继承性问题。因此设计优效性试验时考虑非劣效作为可接受的结局可能产生非预期的后果。另外,结果解释时假如考虑等效性界值的改变,界值变大是不被接受的,而有数据支持的界值变小则是可接受的。
关于界值选取问题,稍后会专文介绍。欢迎拍砖!
Ref: EMA CPMP. Points to consider on switching between superiority andnon-inferiority.2000
作者:广州奥咨达医疗器械技术股份有限公司 临床研究事业部
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632