OLABS ∨
解决方案 ∨
1.NovoTTF-100L系统
2019年5月23日,美国FDA通过人道主义器械豁免程序(HDE)批准了Novocure公司的NovoTTF-100L系统用于成人不可切除、局部晚期或转移性恶性胸膜间皮瘤(Malignant Pleural Mesothelioma, MPM)患者,可与培美曲塞和铂类化疗同时使用。
NovoTTF-100L系统一种便携式器械,由电场发生器、电场换能器(绝缘陶瓷盘)、连接电缆、电源、手提包、电池和电池充电器组成。电场换能器从电场发生器连接到患者的胸部,向患者提供治疗。患者在经培训的医师指导下在家中使用。患者每天在家中使用该器械至少18小时直至疾病进展或没有显著毒性。
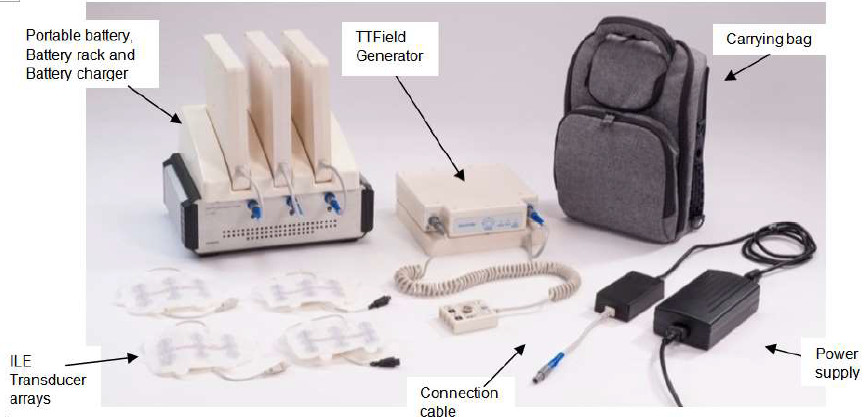
NovoTTF-100L系统利用电场扰乱肿瘤细胞的增殖并摧毁它们。NovoTTF-100L利用了癌细胞的生物学特性,使它们容易受到交替电场的影响。这些特殊的中频(100-300 kHz)电场可以改变肿瘤细胞的有丝分裂。在细胞分裂过程中,NovoTTF-100L会破坏有丝分裂纺锤体微管的组装,导致细胞内大分子和细胞器的介电性脱位。这些过程导致细胞膜的物理破坏和程序性细胞死亡(凋亡)。
2.NovoTTF-100L系统研发背景
2011年04月08日美国FDA批准了一款新型的脑胶质瘤治疗器械(PMA号:P100034)Novo TTF-100A System。NovoTTF-100L就是基于Novo TTF-100A进行的适应证拓展。Novo TTF-100A贴于患者的头部,通过放置在头皮上的电极在大脑内产生交变电场,而Novo TTF-100L则是由于患者的胸壁。Novo TTF-100A的电场频率为200kHz,而Novo TTF-100L的电场频率为150kHz。
由于Novo TTF-100A上市之前从未有同类产品上市,因此其上市过程是比较漫长的。为获得Novo TTF-100A的上市许可,申办方分别进行了预试验和注册试验。预试验为10例的单组试验,预试验的所有受试者都随访至死亡,其中两名受试者在开始研究6.5年后依旧存活。Novo TTF-100A的注册试验为随机对照研究。入选的受试者均为已经被诊断为GBM,进行常规治疗(手术和化疗后化疗)后依旧复发或进展的患者。试验组受试者接受Novo TTF-100A治疗(120例),对照受试者接受最佳护理标准(117例)。
试验结果显示,两个治疗组的总生存率(os)没有显著差异【中位数OS试验组=6.3 vs.对照组=6.4个月;Log-rank p=0.98,危险比(HR)=1.0,95%CI(0.76,1.32)】。试验组1年生存率为21.9%,对照组1年生存率为22.1%。而试验组6个月无进展生存率为21.4%,对照组6个月无进展生存率为15.2%。试验组的受试者生活质量在高于对照组。虽然注册试验未满足主要评价指标(总生存率)的研究假设,但次要指标(6个月无进展生存率和生活质量有改善),最终FDA还是批准了这款器械。
而Novo TTF-100L是通过人道主义器械豁免程序(HDE)取得上市注册许可。该注册试验通过前瞻性、单组目标值法,在13家中心对80名无法手术切除,局部晚期和转移性的恶性胸膜间皮瘤患者进行了临床试验(STELLAR研究),这些患者使用NovoTTF-100L系统以及标准的2药物化疗方案。主要评价指标为总生存期(OS),次要评价指标为无进展生存期(PFS)、肿瘤影像应答率(RR)、1年生存率、2年生存率。
该临床试验的中位生存期(OS)为18.2个月(95% CI:12.1~25.8),中位无进展生存期(PFS)为7.6个月(95% CI:6.7-8.6),1年生存率为62.2%(95% CI:50.3%~72.0%)、2年生存率41.9%(95% CI:28.0%~55.2%)。此外,还进行了亚组分析,经分析上皮样的恶性胸膜间皮瘤患者OS和PFS要好于非上皮样的恶性胸膜间皮瘤患者。不良事件发生率40%,严重不良事件发生率25%。4名患者报告严重的皮肤问题,停止治疗后皮疹消失。
3.电场治疗癌症的未来价值
Novo TTF的技术门槛其实不高,产品的研发技术并不大,很多做康复理疗类器械的企业都有能力做。预计受FDA审批的影响将会有较多的中频治疗仪厂家考虑进行临床试验。如何保证充足的资金将决定该临床试验是否可以如期开展,优先开展临床试验的企业将具有先发优势。
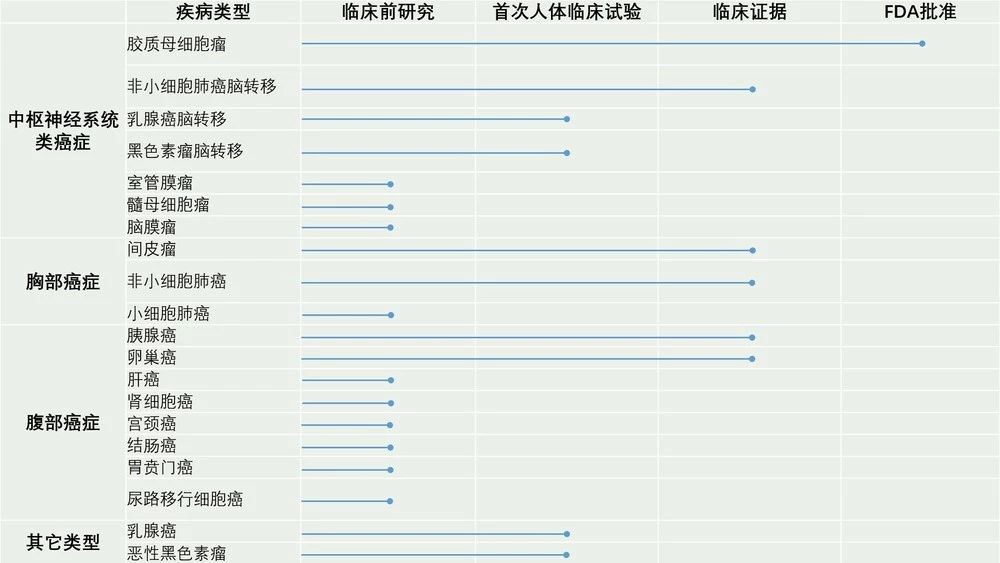
国外同类产品临床试验不同适应证的进度。
4.产品注册分析
目前中国境内无同类产品上市,该产品要获得NMPA上市批准只能采用临床试验进行注册路径。但若申办方的产品是代理Novo TTF的进口注册,则可参考《接受医疗器械境外临床试验数据技术指导原则》提交Novo TTF在FDA以及大型随机对照研究的数据;
目前中国境内无同类产品上市,则产品的安全性和有效性未知。借鉴Novo TTF-100A以及参考“植入式骶神经刺激器套件(CQZ1800078)”的注册经验,该产品在临床试验开始前有可能会被要求进行动物试验。请申办方参考相关要求完成动物试验;
理论上,对于中国境内无同类产品的全新器械,在开展注册试验前应首先进行10~30例的预试验,以初步验证产品的安全性和有效性。但鉴于境外的同类产品已经被写入2018年NCCN指南和《脑胶质瘤诊疗规范(2018年版)》,申报产品若申请“脑胶质瘤”适应证,是否还需要进行预试验需要与CMDE沟通以及各医院伦理委员会。如果CMDE和各医院伦理委员会不强制要求可免于进行预试验,最终结论以CMDE的意见为准。
若进行注册试验,有两种设计思路可供申办方参考。一是,采用常规的随机对照试验,由于没有同类产品上市,一般采用以无治疗作对照,采用优效性检验;二是,在条件允许的情况下,可向CMDE咨询是否可以采用单组目标值法。
5.人道主义器械豁免程序
根据美国1984年的《孤儿药物法》,一种罕见疾病被定义为一种影响美国20万人以下的疾病或病症。目前,在美国,已知的7000种罕见疾病中只有一部分有经批准的治疗措施。由于罕见的疾病或病症只发生在少数患者身上。因此,很难收集足够的临床证据来满足FDA对安全性和有效性的评价标准。为了应对这一挑战,美国国会在1990年的《安全医疗器械法》中加入了一项条款,为治疗罕见疾病或病症的产品提供新的监管途径。这是人道主义器械豁免程序(Humanitarian Device Exemption Program)。
人道主义使用器械(Humanitarian Use Device, HUD):一种旨在帮助患者治疗或诊断每年影响美国不超过8000人的疾病或病症的医疗器械。
人道主义器械豁免(Humanitarian Device Exemption, HDE):针对HUD的上市申请。HDE不受《联邦食品、药品和化妆品法案》第514和515节的约束,并受到一定的利润和使用限制。
可以采用盈利方式出售的HDE器械,但数量仅限于度分配销售数(Annual Distribution Number, ADN)。如果FDA认定HDE持有人有资格以营利为目的出售该器械,FDA将确定ADN并通知HDE持有人。
ADN是通过每年治疗或诊断个人所需的合理器械数量乘以8000来计算的。例如,如果根据预期用途,每个患者每年使用两个HDE器械,则该HDE器械的ADN将为16000(即2×8000)。如果一年内销售的的器械数量超过ADN,制造商可以继续销售该器械,但不能在该年的剩余时间内赚取利润。
作者:广州奥咨达医疗器械技术股份有限公司 临床研究事业部
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632