OLABS ∨
解决方案 ∨
一、引言
骨科,临床常规科室,其病种涵盖所有与运动相关的疾病,如骨折、脱位、韧带损伤、四肢神经损伤等,因此骨科也被称之为运动医学。骨科的病种繁多,在人的一生中均占有一席之地,从先天性髋关节发育不良到特发性脊柱侧弯,从骨肉瘤到创伤性骨折,从颈椎病到膝关节骨性关节炎,从骨质疏松到股骨粗隆间骨折。人生的每一阶段,几乎都离不开与骨科打交道。而且相关病种轻重缓解也不同,小至手指损伤,大至骨盆骨折;轻至皮肤划伤,重至多发伤;急至骨折,缓至骨关节炎,均有涵盖。正因骨科病种繁多且轻重缓急皆有不同,因此其需要多种解决方法来解决这类问题。
骨科医疗器械正好给这些方法提供了应用基础:如因膝关节病而产生了膝关节假体系统,因脊柱相关疾病而产生了椎弓根钉内固定系统,因创伤骨折而产生了钢板、髓内钉等内固定系统等等。由此可见,骨科器械犹如浩瀚星海中的满天星辰,数之不尽,这么多的骨科手术医疗器械如何进行相关分类呢?
从法规角度出发,按照《医疗器械分类目录》,可大致分为骨科手术器械和无源植入器械两大类,其中无源植入器械一级产品类别分为五类:骨接合植入物、运动损伤软组织修复重建及置换植入物、脊柱植入物、关节置换植入物和骨科填充和修复材料;从临床角度出发,则可按照临床科室分类方法对骨科器械进行大致分类。法规规定的相关详细分类可参照《医疗器械分类目录的公告(2017年第104号)》中的《医疗器械分类目录》,在此就不一一展开详述了。下面,我们就从临床角度出发,尝试性对骨科器械进行一个初步的临床分类。
二、骨科相关器械及临床分类
1骨科临床常见分科
2骨科器械的临床分类
2.1 创伤骨科相关植入类器械
创伤骨科中的“创伤”可以简单理解为所有意外损伤的骨折、肌腱断裂、软组织撕裂等运动损伤集合。此分类下的器械涵盖所有与“创伤”相关的器械。相关的器械有,适用于骨折的内固定和外固定植入耗材,如外固定支架、髓内钉系统、钢板内固定系统、螺钉、骨填充材料、钢丝、钛缆等;适用于肌腱断裂、软组织撕裂的相关固定材料,如人工肌腱、异体肌腱、肌腱缝线等。
2.2 脊柱外科相关植入类器械
顾名思义,脊柱外科主要涵盖脊柱相关病种,如腰椎间盘突出症、腰椎椎管狭窄、颈椎病、腰椎滑脱等。在此分类下的器械,涵盖所有与脊柱相关的植入物类器械。相关的器械有,椎弓根钉内固定系统、椎间融合器、适用于椎体成形的球囊和骨水泥、人工椎间盘、3D打印脊柱人工椎体等。
2.3 关节外科相关植入类器械
关节外科主要涉及人体相关关节的病种,诸如膝关节骨性关节炎、先天性髋臼发育不良、肩关节习惯性脱位、股骨头坏死等。在此分类下的器械,涵盖所有与关节相关的植入物类器械,大致可分为关节假体类和关节修复类器械。关节假体类器械有,肩关节假体系统、髋关节假体系统、膝关节假体系统、踝关节假体系统、肘关节假体系统、指关节假体系统、腕关节假体系统等;关节修复类器械有,带线锚钉、关节镜用缝合器、前交叉韧带固定螺钉、带袢钛板等。
2.4 小结
因临床病种的特殊性,临床上创伤、脊柱和关节的分科也不是绝对的,相互科室之间病种也有所交叉,因此医疗器械有会有所交叉。譬如,老年股骨颈骨折理论上应属于创伤类,但是,由于此类骨折优选术式为髋关节置换术(全髋关节置换术或人工股骨头置换术),因此会使用到髋关节假体系统;又如,年轻脊柱椎体骨折患者,理论上应当属于创伤类,但因手术方式为椎弓根钉内固定术,因此也会应用椎弓根钉内固定系统。此种分类方式因为临床的特殊性,不可能在分类上做到非黑即白,因此需要辩证看待。
类。
三、骨科医疗器械临床阶段相关法规简述
骨科医疗器械在临床阶段涉及的法规主要涉及骨科产品相关指导原则和《免于进行临床试验的医疗器械目录》,下面就这两类相关法规进行大致整理:
1骨科器械相关指导原则
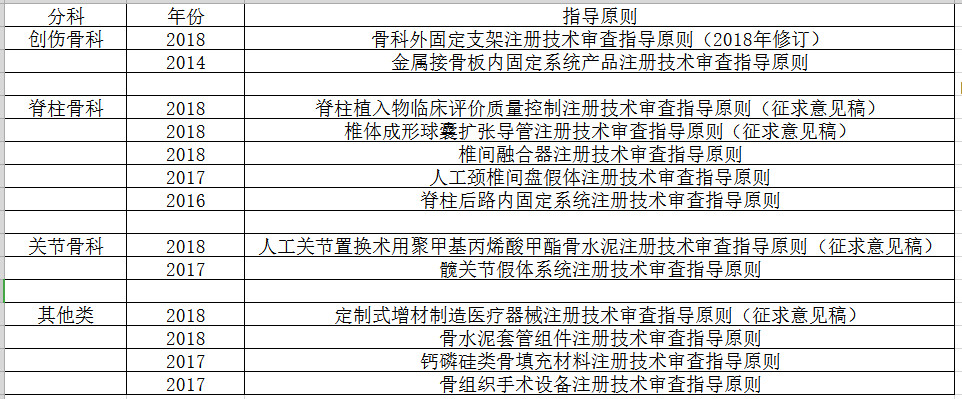
22018年《免于进行临床试验的医疗器械目录》(以下简称《目录》)
根据《医疗器械临床评价技术指导原则》规定,第二类、第三类医疗器械(不含体外诊断试剂)的临床评价方式有三种,分别为:第一种:列入《免于进行临床试验的医疗器械目录》产品的临床评价;第二种:通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价;第三种:临床试验。那么对于第一种进行临床评价方式的骨科Ⅱ、Ⅲ类器械来说,最主要的是《目录》内的器械主要有哪些,下面,依然按照骨科常见分科方式,以及按照手术操作类和手术植入类器械分类方式,对《目录》内的骨科器械进行了基本的分类:
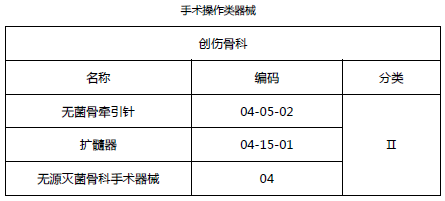
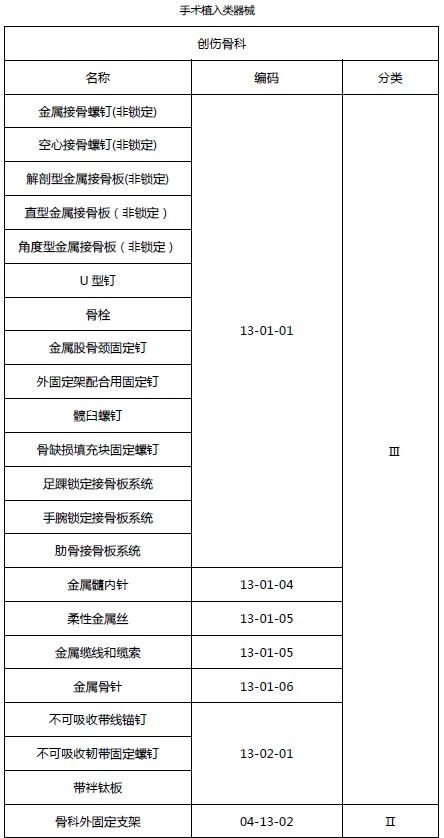
2.1 创伤骨科类医疗器械(免临床试验部分)
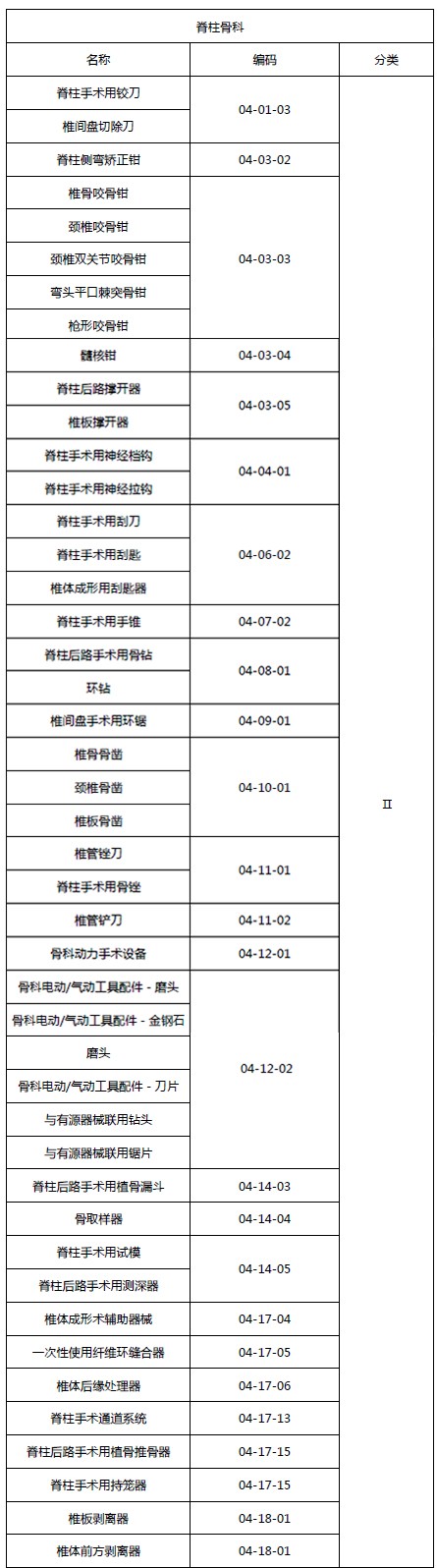
2.2 脊柱骨科类医疗器械(免临床试验部分)
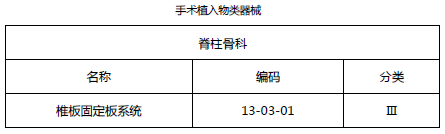
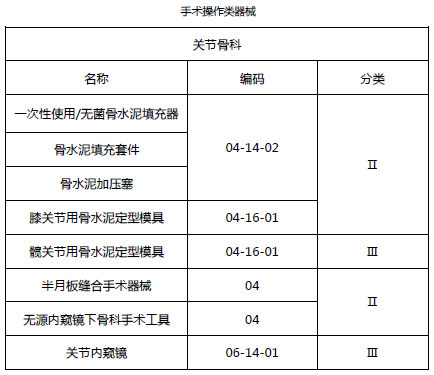
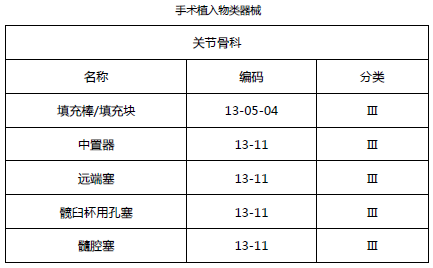
2.3 关节骨科类医疗器械(免临床试验部分)
参考文献:
[1].《器械分类目录》.国家药品监督管理局.2017
[2].《免于进行临床试验的医疗器械目录》.国家药品监督管理局.2018
[3]. 陈玉芳.医疗器械临床评价法规的理解和探讨[J].中国医疗器械信息,2017,23(09):30-31+35.
作者:广州奥咨达医疗器械技术股份有限公司 临床研究事业部
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632