OLABS ∨
解决方案 ∨

身处医疗器械行业,你是否经常被这样的新闻所惊吓:
“全国飞检!9家械企被查,4家停产整改,1家立马被踢出集采!”
同时,你是否会为这样的新闻所吸引而艳羡不已:
“5家械企24款器械产品进入优先审批,评审时间减少一半!”
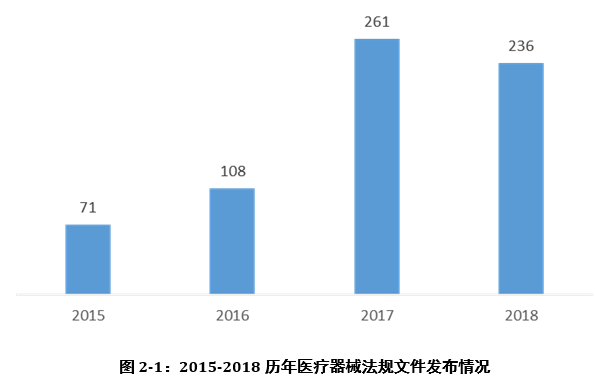
想要进入医疗器械行业,行业法规是第一只拦路虎!近几年更是医疗器械行业法规更新发布的高峰时期,2018年各类医疗器械政策法规、办事指南、指导原则等法规文件竟达236项之多!以下是奥咨达蓝皮书系列《2018奥咨达医疗器械行业研究报告》专业统计的2015-2018法规文件发布情况。
如果有这样一本书:
可以系统回顾2018年中国医疗器械行业监管变化历程,从法规总体发布概况、重点法规事件解析、年度注册状况、监管动态等方面分别阐述2018年度监管动态……
可以从头到尾阐述行业母法的修订过程,系统梳理医疗器械产品注册前、中、后期和上市后所适用的法规,剖析近来重磅的医疗器械上市许可持有人制度……
可以告诉您2018年哪些产品类别通过注册最密集,哪些产品最容易通过创新、优先审批,全国飞检企业主要存在哪些缺陷项及相应的改进措施……
动心吗?期待吗?想拥有吗?


《2018奥咨达医疗器械行业研究报告》为您配齐所有!
加强监管、保证行业合法合规,鼓励创新、激活产业发展潜力是年度法规监管的主旋律。
合规是医疗器械产品永恒的生命线!
如何实现?尽在《2018奥咨达医疗器械行业研究报告》!
2019年4月下旬重磅面世,更多专业内容不容错过,数量有限,欲购从速!

扫描二维码预定
2018奥咨达医疗器械行业研究报告目录
编 委 会
序 言
目 录
概 述
第一章 生产组织方式创新 改变产业发展格局
一.医疗器械上市许可持有人制度的探索
(一)政策发布的背景
(二)政策在上海试点的情况
(三)政策在广东、天津的拓展
(四)政策对产业发展的影响
二.医疗器械3C产业平台,是顺应时代发展的创新模式
(一)医疗器械CDMO的诞生
(二)医疗器械CDMO的价值
(三)奥咨达3C创新平台,一站式闭环服务,填补医疗器械产业空白
(四)奥咨达3C创新平台,实现医工转化新业态,推动产业集聚发展
(五)奥咨达3C创新平台,促进全国各地医疗器械产业均衡发展
(六)奥咨达3C创新平台,构建创新医疗器械产业生态圈
第二章 2018年中国医疗器械法规和监管概览
一.2018年中国医疗器械法规发布概况
二.重点法规及监管事件解析
(一)监管“母法”的修订
(二)产品注册前的相关法规文件
(三)产品注册中的适用法规文件
(四)产品注册后的相关法规
(五)产品上市后的相关规章
(六)任重道远——上市许可持有人制度
三.近年国家局注册审批及创新优先审批情况
(一)2018年国家局注册审评审批情况
(二)2015-2018年国家局注册审评审批情况
(三)国家创新医疗器械审批概况
(四)国家优先审评审批医疗器械情况
四.近年医疗器械注册退审和撤审汇总
(一)2018年国家局不予注册发布情况
(二)2014-2018年国家局不予注册统计
(三)2014-2018年企业主动撤回情况统计
五.2018年国内医疗器械监管动态
(一)境内医疗器械生产企业飞行检查情况
(二)境外医疗器械生产企业飞行检查情况
(三)医疗器械经营质量管理规范飞行检查
(四)医疗器械质量抽检情况
(五)医疗器械召回情况
……
附录
附录1. 2018年国务院发布关于医疗器械的法规文件清单
附录2. 2018年其他部委发布关于医疗器械的法规文件清单
附录3. 2018年国家药监主管部门发布关于医疗器械的法规文件情况
附录4. 2018年国家药品监督管理局发布医疗器械指导原则的通告
附录5. 2018年市场总局、国家药品监督管理局发布医疗器械法规文件征求意见稿
附录6. 2018年发布医疗器械行业标准清单
附录7. 2014年至今国家局创新医疗器械公示产品清单

如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632