OLABS ∨
解决方案 ∨
——医疗器械制度解读分享会深圳站
8月24日下午,由奥咨达医疗器械服务集团、银星投资集团有限公司主办,医疗器械临床转化产业联盟协办的医疗器械注册人制度解读分享会在深圳银星科技大厦成功举办。奥咨达医疗器械集团董事总经理钟志辉、银星集团常务副总裁张聪杰发表演讲,政府机构、医疗器械企业、投资机构、行业组织及媒体各位嘉宾代表出席了本次行业盛会。
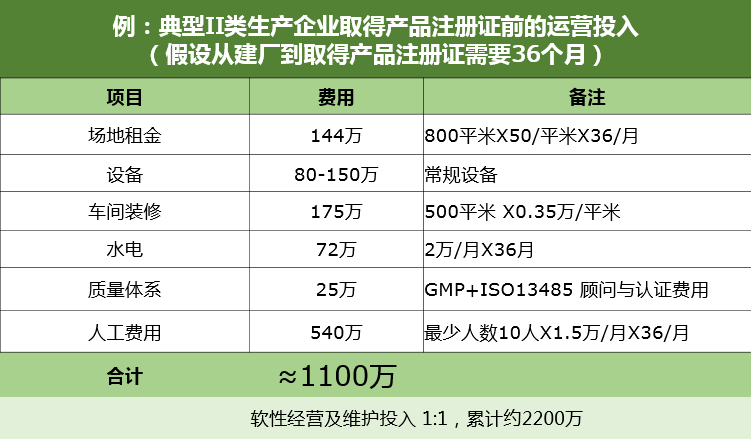
会议开始,主持人奥咨达深圳CDMO总经理熊伟先生发表开场致辞,为这次盛会揭开序幕。随后,奥咨达董事总经理钟志辉先生讲解《医疗器械注册人制度对行业的影响》。 在原有的制度下,医疗器械产品注册证与医疗器械生产许可证的捆绑,使得医械企业举步维艰。医疗器械企业面临着等候时间长、前期投入大、合规合法风险高、大量资源在注册等候期闲置浪费等诸多困局,同时还承担着巨大的试错成本。这种“捆绑”模式无疑影响医械企业创新研发和持续提高产品质量的责任和热情,限制创新要素的合理配置,与国际通行规则及《医疗器械监督管理条例》立法精神背道而驰。 随着药监局相继对上海、天津、广东医疗器械注册人制度的落实,医疗器械产品注册证与医疗器械生产许可证的正式“解绑”,符合条件的医疗器械注册申请人可以单独申请医疗器械注册证,然后委托给有资质和生产能力的生产企业(简称受托生产企业)生产,这无疑给医疗器械行业带来了生机与希望。 医疗器械注册人制度对行业的影响,存在诸多益处: ●强化注册人全生命周期责任,鼓励创新研发和持续改进质量; ●科研人才、研发机构和创新企业集聚,优化创新资源的市场配置; ●突破土地资源和环境资源约束,推动医疗器械产业链上下游分工与合作,提升产业能级,形成先进制造优势; ●对接国际医疗器械制造通行规则,促进高端医疗器械本土生产; ●完善医疗器械注册生产监管制度,促进审评标准提升和审评统一,建立有效的跨区域事中事后监管方式; ●加快医疗器械上市,满足市民日益迫切的高品质健康服务需求。 奥咨达钟志辉董事总经理不仅为同行们讲解了医疗器械注册申请人执行的要点和细节,并重点讲解到8月20日正式发布的《广东省医疗器械注册人制度试点工作实施方案》。其主要内容有: (一)医疗器械注册申请人取得医疗器械注册证的,作为医疗器械注册人(以下称:注册人)。 注册人以自己名义把产品推向市场,并对产品全生命周期承担法律责任。 (二)中国(广东)自由贸易试验区(以下称:自贸区)内的医疗器械注册申请人,以及广州、深圳、珠海市的医疗器械注册申请人(以下称:申请人)可以委托广东省医疗器械生产企业(以下称:受托人)生产样品。 (三)注册人可以自行生产或者委托其他企业生产医疗器械。取得注册证后,注册人具备相应生产能力的,可以在办理医疗器械生产许可后自行生产;注册人不具备相应生产能力的,可以委托其他企业生产,并办理委托生产相关手续。受托人不具备相应生产资质的,可提交注册人的医疗器械注册证办理生产许可。受托人已取得相应生产资质的,应将受托生产产品信息登载进其生产许可证。 (四)注册人可以自行销售医疗器械,无需办理医疗器械经营许可或者备案,也可以委托具备相应条件的医疗器械经营企业销售医疗器械。委托销售医疗器械的,注册人应当对所委托销售的医疗器械质量负责,与受托经营企业签订委托协议,明确双方权利、义务和责任,并加强对受托经营行为的管理,保证其按照法定要求进行销售。 随后,作为本次会议主办方之一的银星集团的常务副总裁张聪杰为参会来宾介绍了银星科技园。银星集团是一家以实业投资、产业地产开发与运营为主营业务的跨行业综合性高科技企业集团。银星科技园是集团2001年投资开发的首个生态科技产业园,占地50万平方米。银星不仅是奥咨达深圳3C平台的“房东”,更是奥咨达深圳3C平台的“股东”,共同创建医疗器械3C(CDMO+CRO+CSO)服务平台。银星集团以打造一个可持续发展的“生命健康产业园”为目标,与园区企业共成长,同发展。张聪杰常务副总裁讲解了银星集团对本次注册人制度的支持计划,针对注册人制度引发的CDMO新模式,银星集团特推出全新产业园,助力创新研发成果的孵化与落地,协助奥咨达对接医疗器械全产业平台的建设! 会议的压轴,奥咨达钟志辉董事总经理在会上就“CDMO+CRO整体解决方案”还分享了奥咨达跟随注册人制度脚步,率先建立的CDMO+CRO医疗器械全产业第三方服务平台。这是医疗器械注册人制度下的新生产物,接受医疗器械注册申请人的委托,为其提供包含医疗器械研发转化、产线筹建、体系建立、工艺开发、原材料筛选、样品生产、性能验证、仓储物流等阶段等医疗器械全生命周期开发管理服务。结合奥咨达深耕CRO多年的行业优势,打造资本聚集、技术聚集、法规聚集与产业聚集的医疗器械CDMO平台,促进医疗器械产业加速升级。奥咨达目前已在上海、广州、深圳三地同步筹建CDMO+CRO平台,快的将于9月正式投入使用。 CDMO+CRO的全产业链服务使得医疗器械的企业不用自行解决工厂选址及工厂建设问题,摆脱繁琐生产线筹建、质量体系筹建及庞大的人员队伍管理;此外,还有繁琐、专业的产品注册及临床试验等一系列问题。这个全新的产业模式,使产品上市周期及资金投入至少缩减30%~60%,实现社会资源共享,避免合规风险,减少资金占用。 分享会还专门设置了线上线下问答环节,奥咨达集团CDMO事业部各负责人从法规解读、研发转化、委托生产等多方面解答线上线下观众提出的问题,将交流气氛推至高潮。 注册人制度的进一步扩展,预示着我国医疗器械行业将迎来新一轮的改革和发展,将为医械从业者带来新的机遇和挑战。对此,钟志辉先生表示,奥咨达作CDMO+CRO平台标准的制定者和注册人制度落地的先行者,将为国内外医疗器械从业者提供全产业链第三方服务,助力各地生物医药产业发展,致力于中国成为医疗器械产业聚集中心。




如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632