OLABS ∨
解决方案 ∨
澳大利亚医疗用品管理局(Therapeutic Goods Administration, TGA)允许企业在10月1日之后正式申请TGA监管批准,以在 2021年11月1日之后在澳大利亚合法地提供家用自测新冠试剂产品。
这是支持澳大利亚 COVID-19 应对政策的国家计划的重要一步,并与70%左右的澳大利亚人接种疫苗的预期时间保持一致。在此之前,澳大利亚禁止向一般民众销售COVID-19的自测产品。因此TGA只接受供专业人员使用的新冠检测试剂注册,完成注册的产品也只能销售给医院、诊所、实验室和护理机构等配备有专业人员的组织。
如其他检测试剂一样,自测试剂需要经过TGA批准进入澳大利亚医疗用品登记表(Australian Register of Therapeutic Goods,ARTG)中。TGA已经开始审查申请注册的自测试剂产品的研究数据和产品信息了。
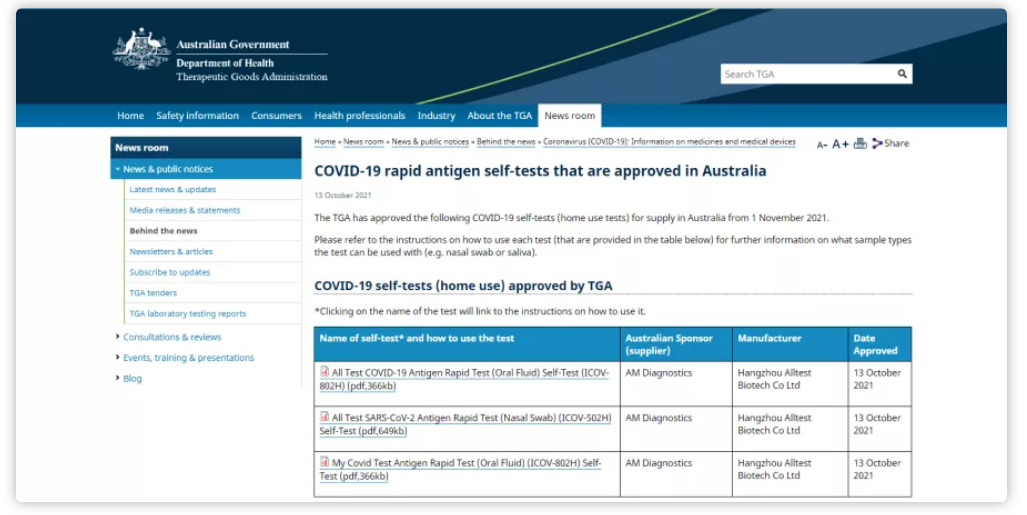
目前,已有一家中国公司的3个家用自测新冠试剂产品被TGA批准于11月1日之后在澳大利亚合法进行销售。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632