OLABS ∨
解决方案 ∨
省药品监督管理局关于提升国产第二类医疗器械注册核查工作效能的通知
各市、州、神农架林区市场监督管理局,省药监局各分局:
为贯彻省委、省政府优化营商环境的决策部署,落实省局《进一步发挥监管职能促进医药产业高质量发展若干措施》(鄂药监发〔2021〕14号)关于“建立医疗器械注册核查新机制”的要求,进一步提升国产第二类医疗器械注册核查工作质效,促进我省医疗器械产业高质量发展,现将有关事宜通知如下:
一、统筹监管检查资源。自2021年9月1日起,国产第二类医疗器械注册核查实行省局审评中心组织、各药监分局实施的工作新模式,整合注册核查与监管执法检查,提高工作效能,避免重复检查。
二、明确职责分工。省局审评中心根据技术审评需要,发起国产第二类医疗器械注册核查任务。各药监分局接到注册核查任务后,应当在20个工作日内完成辖区内申请人注册核查,包括抽调有资质的检查员、开展现场核查、报送核查报告和整改报告、对企业整改情况予以确认等工作。申请人整改时间不计入注册核查时限。
三、强化协调配合。市县市场监管部门应当按照工作要求和安排,加强与各药监分局协同配合,支持本单位具有资质的检查员参与注册核查工作,为加强医疗器械质量安全监管、促进产业高质量发展履职尽责。
四、建立联络机制。各药监分局明确一名联络员,负责对接省局审评中心,协调辖区内国产第二类医疗器械注册核查有关工作。请于8月20日前报送联络员名单至省局审评中心,联系人:张安萍,027-87111662。
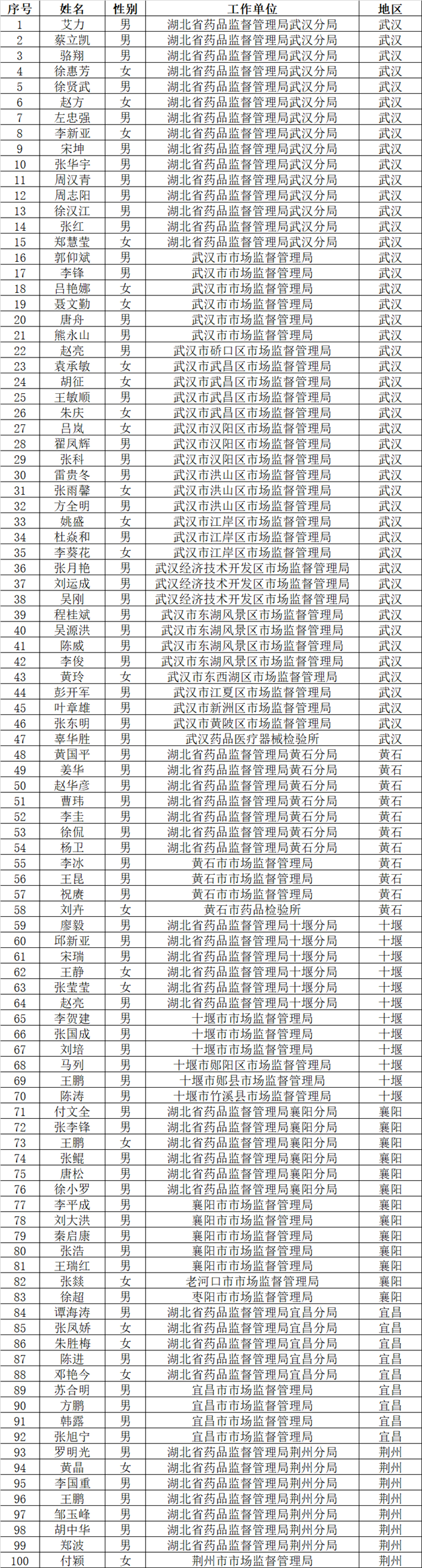
附件:各市州监管部门医疗器械检查员名单
湖北省药品监督管理局
2021年8月13日
各市州监管部门医疗器械检查员名单
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632