OLABS ∨
解决方案 ∨

医疗器械飞行检查情况通告
(2021年第2号)
发布时间:2021-07-21
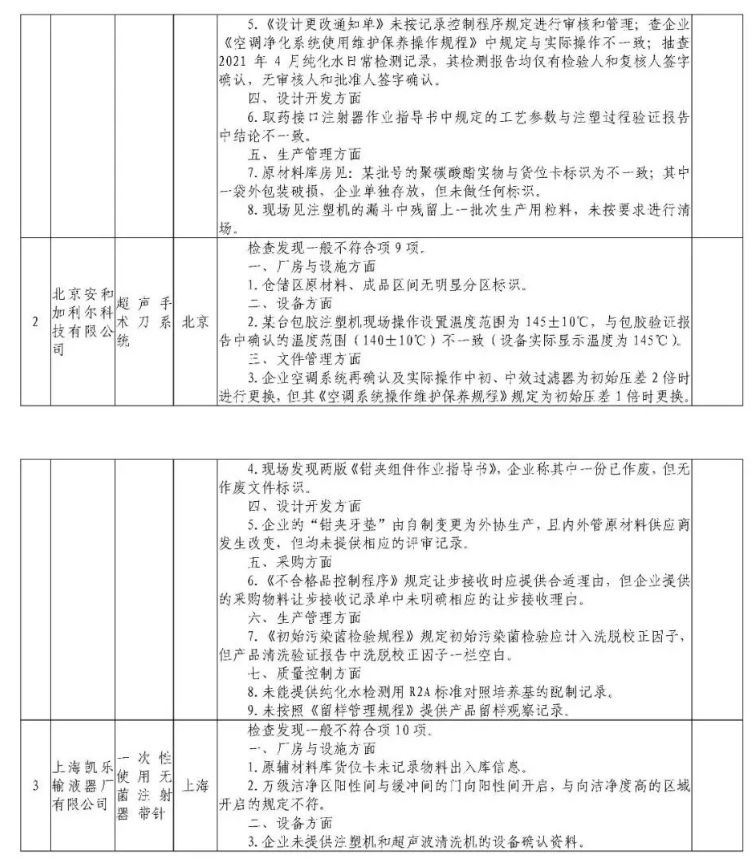
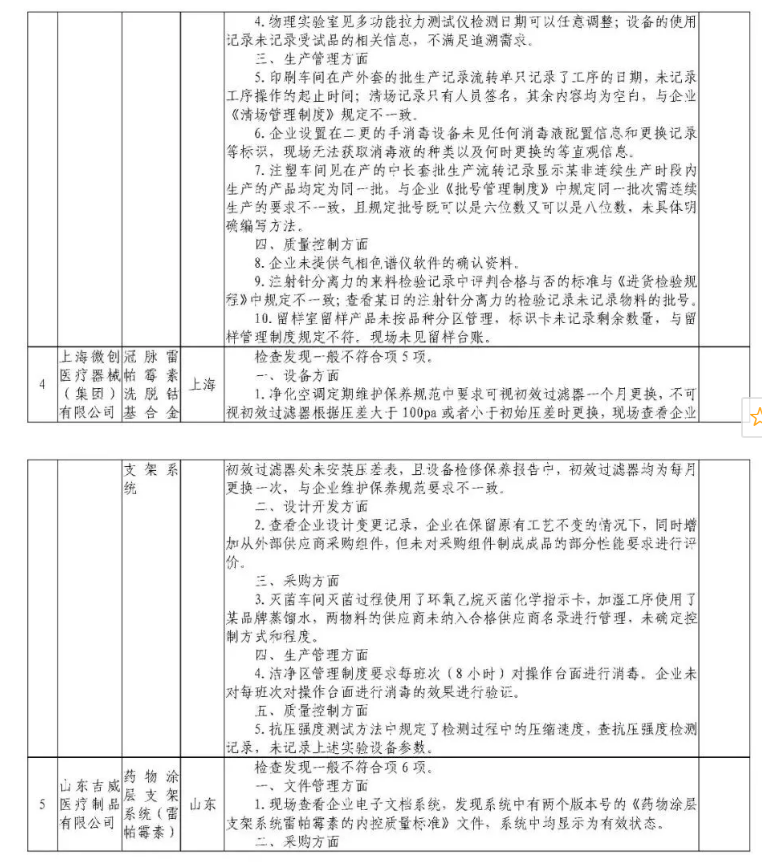
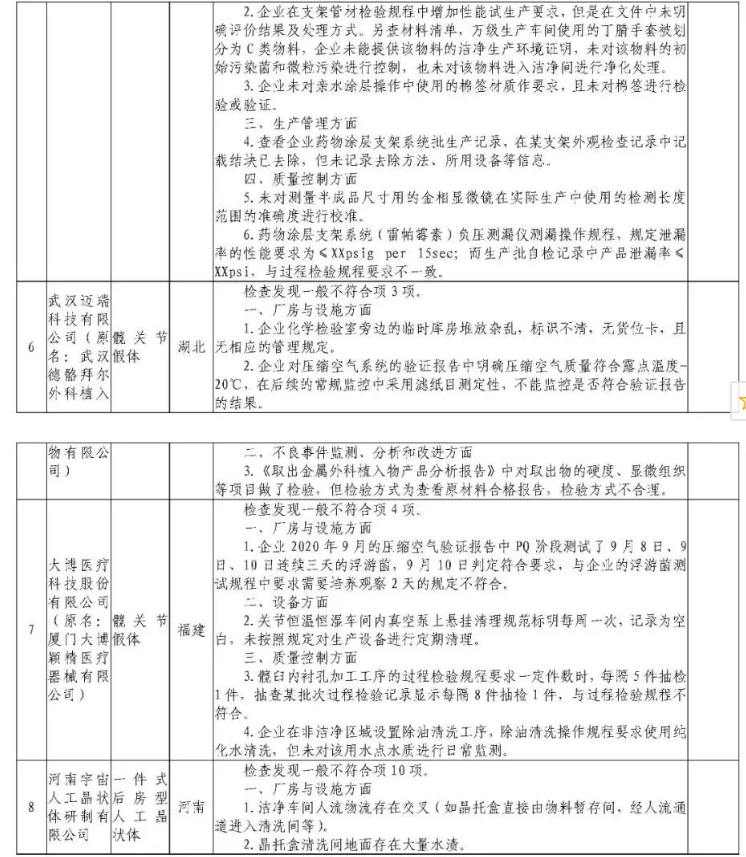
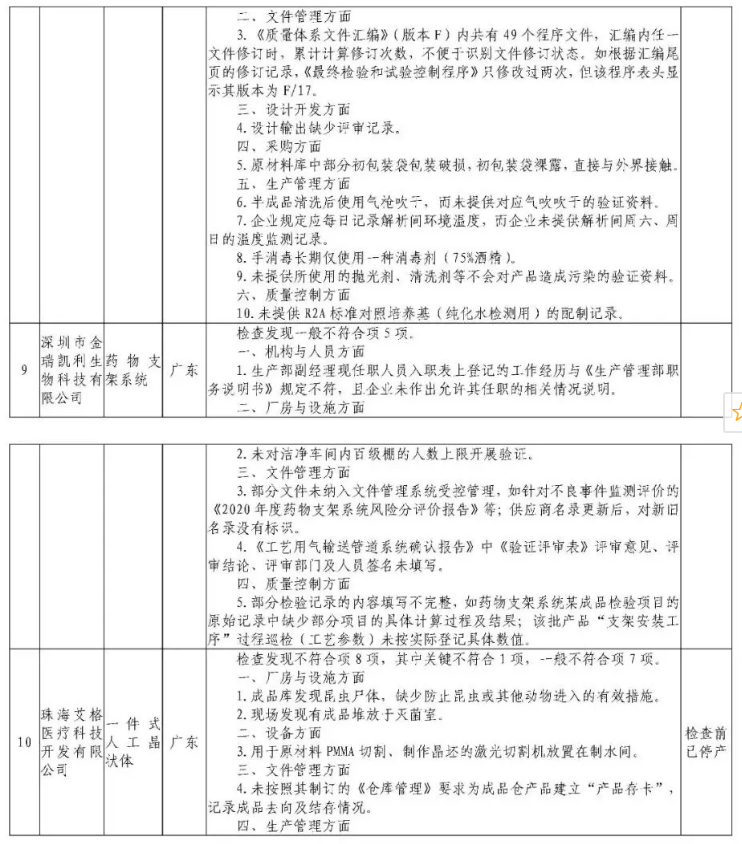
为加强医疗器械监督管理,保障医疗器械安全有效,依据《医疗器械监督管理条例》《医疗器械生产监督管理办法》《药品医疗器械飞行检查办法》《医疗器械生产质量管理规范》及相关附录,以及《食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知》(食药监械监〔2015〕218号)等要求,按照国家药品监督管理局2021年医疗器械检查工作部署,核查中心于2021年4月-5月组织开展了医疗器械生产企业飞行检查工作,发现北京快舒尔医疗技术有限公司等9家企业存在一般项目不符合《医疗器械生产质量管理规范》及相关附录要求;珠海艾格医疗科技开发有限公司(检查前已停产)存在关键项目不符合《医疗器械生产质量管理规范》及相关附录要求。具体情况见附表。
针对检查中发现的不符合要求问题,请相关省、自治区、直辖市药品监督管理局督促企业按要求整改,要求企业评估产品安全风险,对存在安全风险的,应按照《医疗器械召回管理办法》召回相关产品。企业完成整改后,相关省级药品监督管理局应及时组织对整改情况进行确认,并将确认结果报送国家药品监督管理局食品药品审核查验中心。
附件:核查中心2021年第二批医疗器械飞行检查情况汇总.pdf


国家药监局核查中心
2021年7月20日
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632