OLABS ∨
解决方案 ∨

近日,【NMPA】重组胶原蛋白类医疗产品分类界定原则的通告,由国家药监局发布,涉及七个产品。自从2018年8月1日起实施新版《医疗器械分类目录》,中检院与国家药监局先后在2018-2021年发布了多份分界定结果汇总、6840体外诊断试剂分类子目录(2013版)调整、以及个别产品的产品分类界定等。以上所有调整的报告,“医械查”小程序已全数归类录入,方便用户查找。

点击 “医械查” 二维码 体验更功能
如何分类确定 (法律依据)
《医疗器械分类规则》主要用于指导制定医疗器械分类目录和确定新的医疗器械的管理类别,申请人确定产品类别应当依据《医疗器械分类目录》(“医械查”小程序收录最新版《医疗器械分类目录》,除了直接搜索,还可以通过编码快速查询),而不应直接按照《医疗器械分类规则》的判定原则自行判定产品类别。
《医疗器械监督管理条例》第十六条 对新研制的尚未列入分类目录的医疗器械,申请人可以依照本条例有关第三类医疗器械产品注册的规定直接申请产品注册,也可以依据分类规则判断产品类别并向国务院食品药品监督管理部门申请类别确认后依照本条例的规定申请注册或者进行产品备案。
直接申请第三类医疗器械产品注册的,国务院食品药品监督管理部门应当按照风险程度确定类别,对准予注册的医疗器械及时纳入分类目录。
分类流程
一、分类界定流程
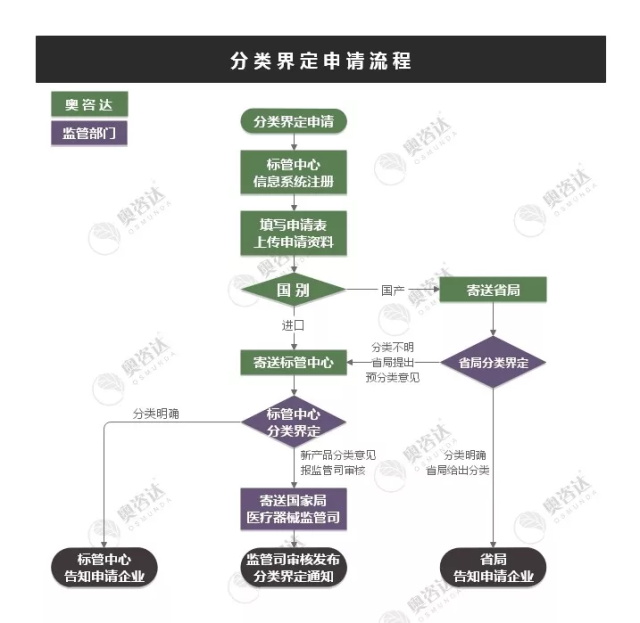
二、 申请材料要求
(一)分类界定申请表;
(二)产品照片和/或产品结构图;
(三)产品技术要求及产品说明书(样稿);
(四)进口上市证明材料(如有);
(五)资料真实性自我保证声明;
(六)其他与产品分类界定有关的材料。其中对于尚未列入《分类目录》等文件的新研制产品,至少还应当提交:
1.与国内外已上市相关产品、《分类目录》或分类界定通知文件中相关产品的分析及对比,并说明符合新研制尚未列入分类目录产品的判定依据;
2.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述(如有);
3.产品的创新内容;
4.信息或者专利检索机构出具的查新报告。
所有申请材料应当使用中文。根据外文资料翻译的,应当同时提供原文。
三、申请状态和结果查询
各省级食品药品监督管理部门、各级医疗器械技术审评部门和申请人登陆“医疗器械分类界定信息系统”,在“操作栏”中点击“查看流程图”,即可查询申请状态和结果。
医械查功能推荐:产品分类
1 按 品名 查询医疗器械
例如 : 在搜索框里输入“重组胶原蛋白”,可以在新版分类目录里找到所有品名包含有“手术刀”的医疗器械。



2 按层级分类查找医疗器械分类目录
例如 : 依次点击“有源手术器械”——“超声手术设备及附件”——“超声手术设备”。


就可以找到“超声手术设备”目录下的所有医疗器械:


如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632