OLABS ∨
解决方案 ∨
5月12日,广东省药监局发布《2020年度广东省第二类医疗器械注册工作报告》。
重点内容摘要
一、医疗器械注册工作情况
(一)做好医疗器械应急审批工作
截至2020年12月,广东省共有国产新型冠状病毒检测试剂盒注册证10个,呼吸机注册证23个,医用口罩注册证715个,红外体温计注册证264个,医用防护服注册证21个。推动中山大学达安基因股份有限公司新型冠状病毒2019-nCoV核酸快速检测试剂盒、广州万孚生物技术股份有限公司全国首批新冠病毒抗原检测试剂盒获批上市。广东医用口罩生产企业数量从疫情初期的26家迅速增长至383家,相关产品注册证数量均居全国前列,极大保障了疫情防控工作需要。
(二)推进医疗器械注册人制度试点工作
截至2020年12月31日,广东省共有21家企业72个试点品种获准上市,其中二类品种68个,三类品种4个。
二、医疗器械注册申请受理情况
(一)整体情况
截至2020年12月31日,广东省药监局共受理了第二类医疗器械首次注册、延续注册和许可事项变更注册申请5621项,同比增加了67.99%。2016年至2020年广东省第二类医疗器械首次注册、延续注册和许可事项变更注册申请受理情况如表1所示。
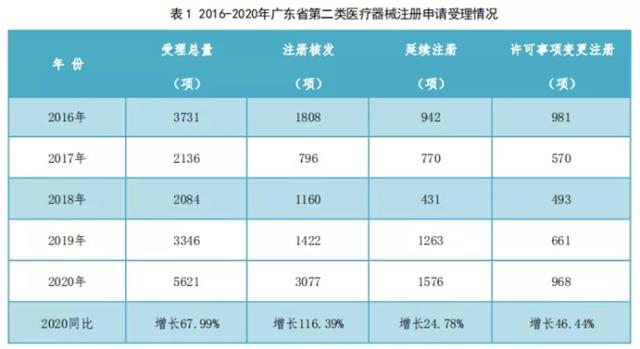
(二)分项情况
以下对2020年度广东省第二类医疗器械的注册受理情况按照是否为疫情防控产品进行分项统计。
1.2020年度广东省第二类医疗器械(不含疫情防控产品)注册申请受理情况如表2所示。

2020年度,广东省第二类有源和无源类医疗器械(不含疫情防控产品)的注册核发受理总量、延续注册受理总量和许可事项变更注册受理总量前列城市分别如图1、2、3所示。



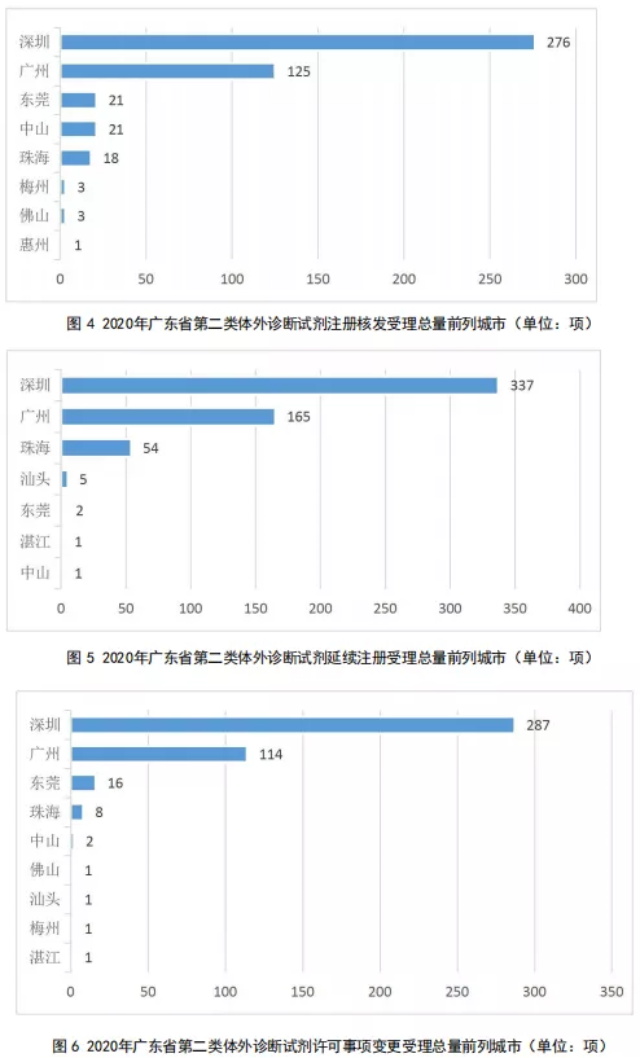
2020年度,广东省第二类体外诊断试剂的注册核发受理总量、延续注册受理总量和许可事项变更注册受理总量前列城市分别如图4、5、6所示。
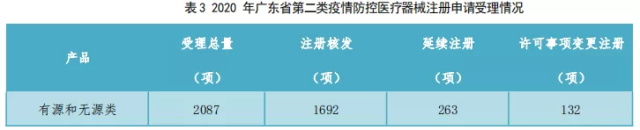
2.2020年度广东省第二类疫情防控医疗器械注册申请受理情况如表3所示。
广东省第二类疫情防控医疗器械的注册核发受理总量、延续注册受理总量和许可事项变更注册受理总量前列城市分别如图7、8、9所示。


三、医疗器械注册审批情况
(一)整体情况
截至2020年12月31日,2020年广东省药监局共完成了第二类医疗器械首次注册、延续注册和许可事项变更注册申请4455项,同比增加了98.53%。2016-2020年广东省第二类医疗器械首次注册、延续注册和许可事项变更注册审批情况如表4所示。

(二)分项情况
1.2020年度广东省第二类有源及无源类医疗器械具体批准品种种类情况
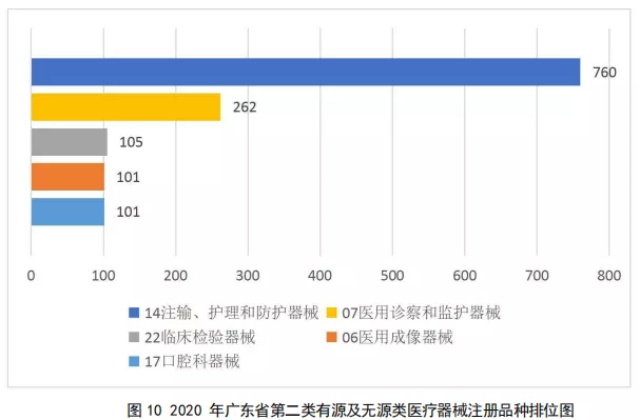
2020年广东省批准注册的第二类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中20个子目录的产品。
注册数量前五位的第二类有源及无源类医疗器械是:注输、护理和防护器械,医用诊察和监护器械,临床检验器械,医用成像器械,口腔科器械。如图10所示。
2.2020年度广东省第二类医疗器械(不含疫情防控产品)注册审批情况如表5所示。
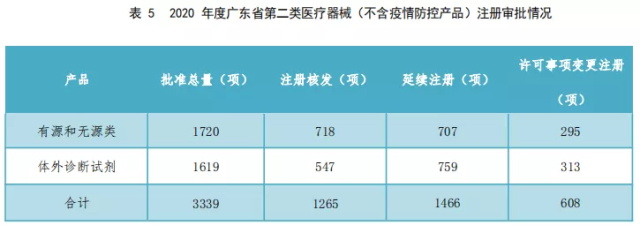
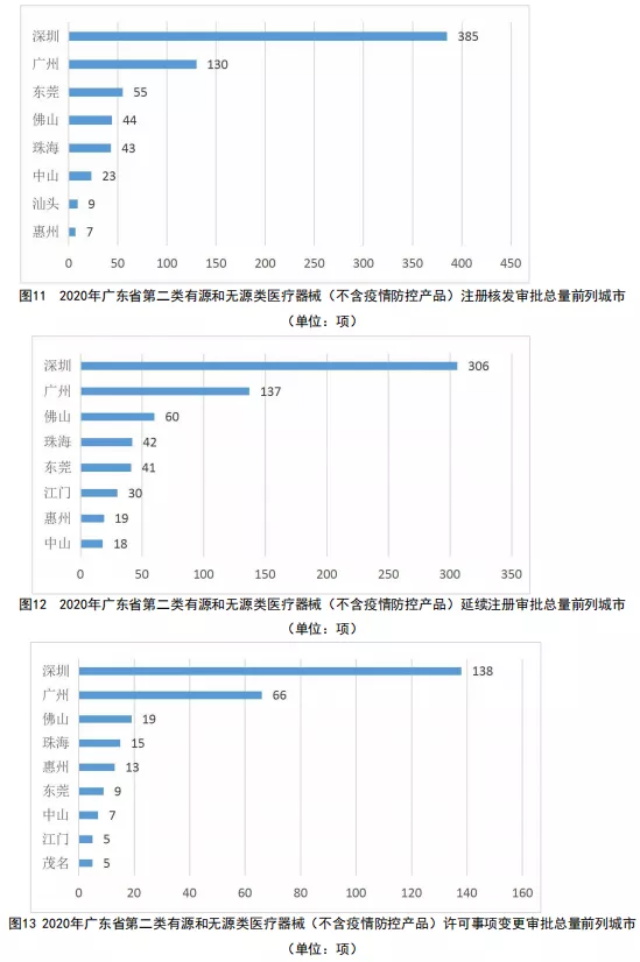
2020年度,广东省第二类有源和无源类医疗器械(不含疫情防控产品)的注册核发审批总量、延续注册审批总量和许可事项变更注册审批总量前列城市分别如图11、12、13所示。
2020年度,广东省第二类体外诊断试剂的注册核发审批总量、延续注册审批总量和许可事项变更注册审批总量前列城市分别如图14、15、16所示。


3.2020年度广东省第二类疫情防控医疗器械注册审批情况如表6所示。
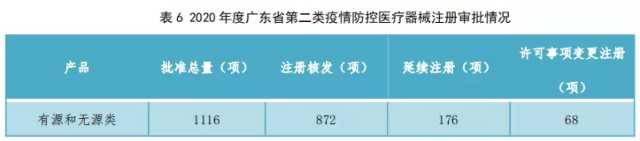
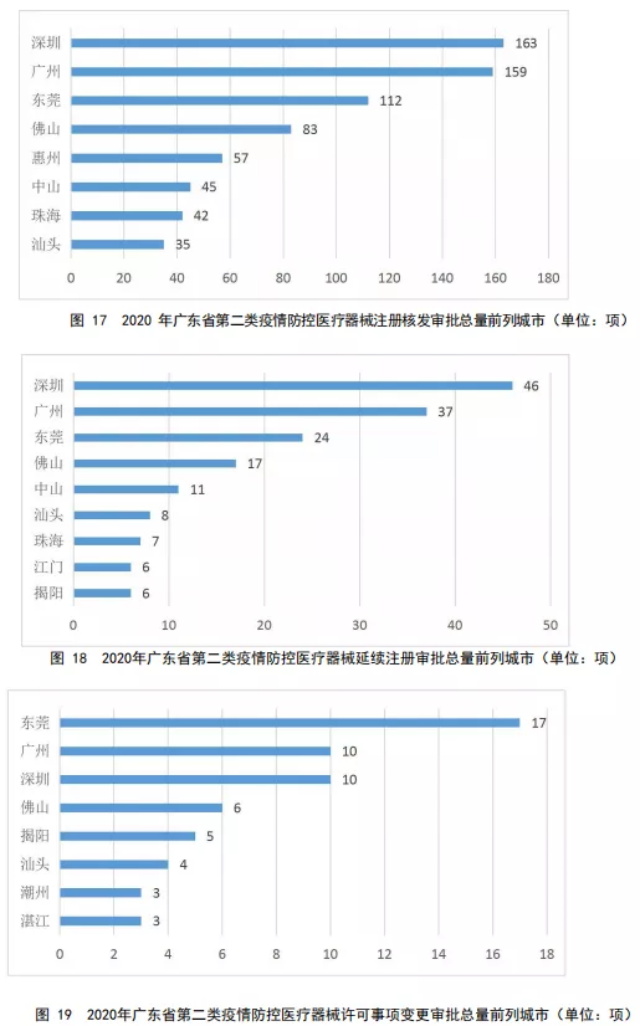
2020年度,广东省第二类疫情防控医疗器械的注册核发审批总量、延续注册审批总量和许可事项变更注册审批总量前列城市分别如图17、18、19所示。
四、创新优先医疗器械注册审批情况
(一)优先审批基本情况
1.进入优先审批程序情况
2020年,广东省医疗器械注册优先审批情况如表7所示。

其中进入国家药监局优先审批程序的医疗器械是:东莞博奥木华基因科技有限公司的胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(半导体测序法),该产品属于列入国家重点研发计划的医疗器械。
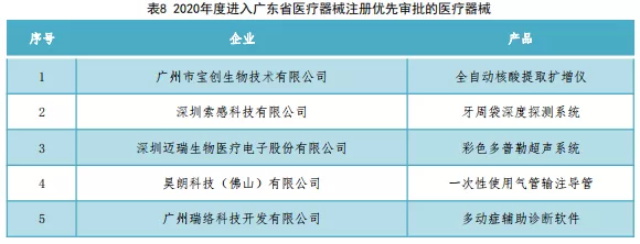
进入广东省药监局优先审批程序的医疗器械如表8所示。
2.2020年已批准上市优先医疗器械情况
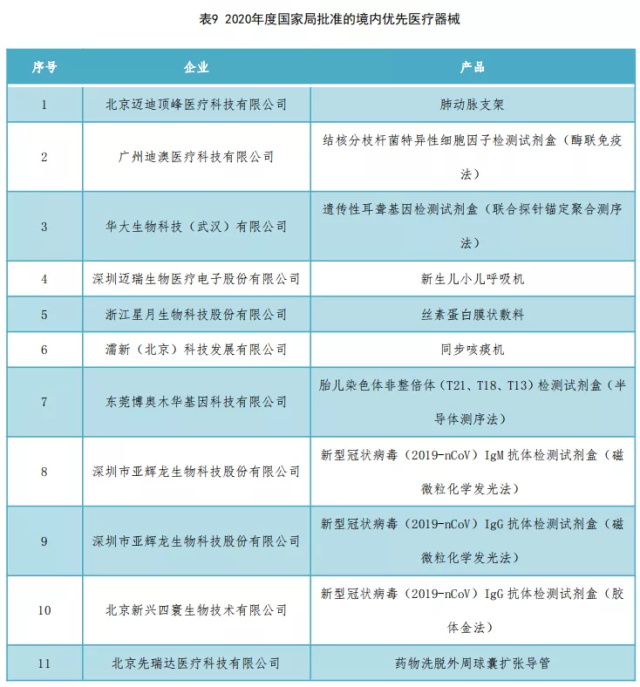
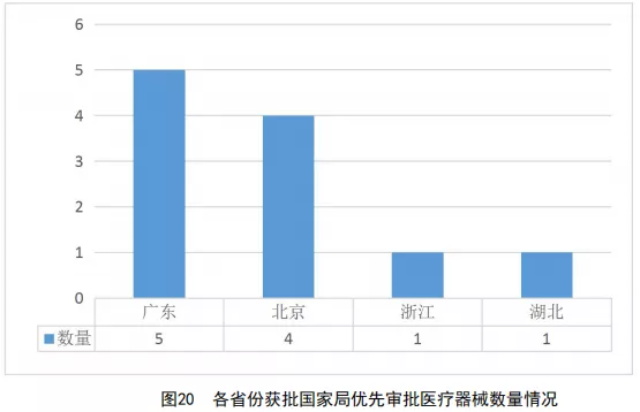
2020年,国家药监局共批准境内共11个优先医疗器械上市,如表9所示。其中,各省份获批国家药监局优先医疗器械数量如图20所示。
(二)创新特别审批基本情况
1.进入创新特别审批程序情况
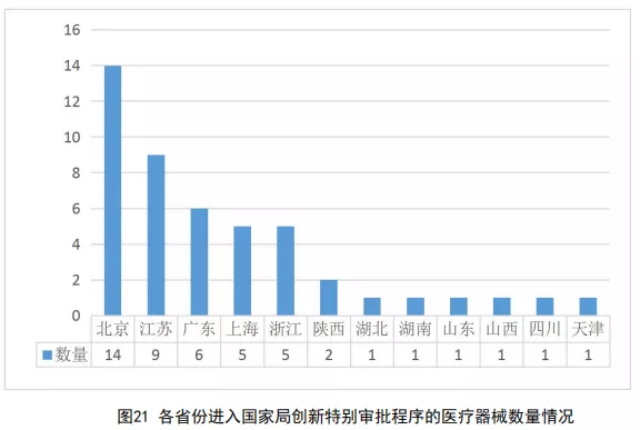
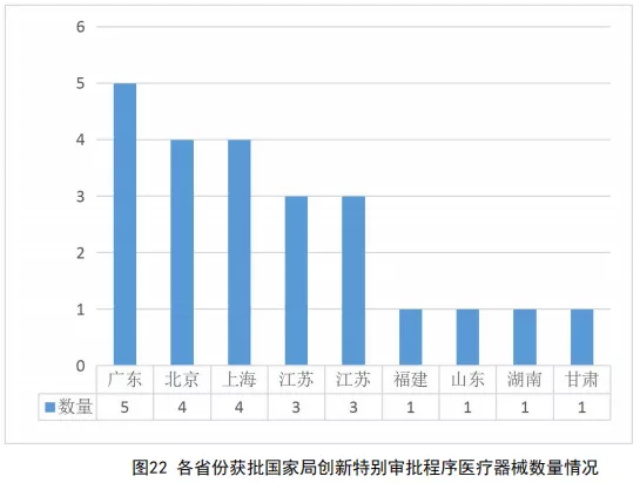
2020年,国家药监局共审核通过了境内47个医疗器械进入创新特别审批程序,各省份进入国家局创新特别审批程序的医疗器械数量如图21所示。
2020年,广东省医疗器械进入创新特别审批程序基本情况如表10所示。

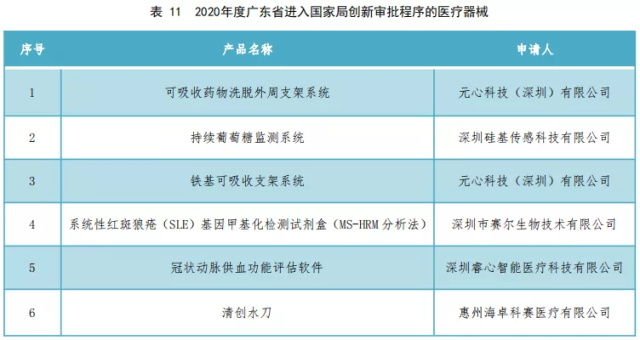
其中,进入国家药监局创新审批程序的产品如下表11所示。
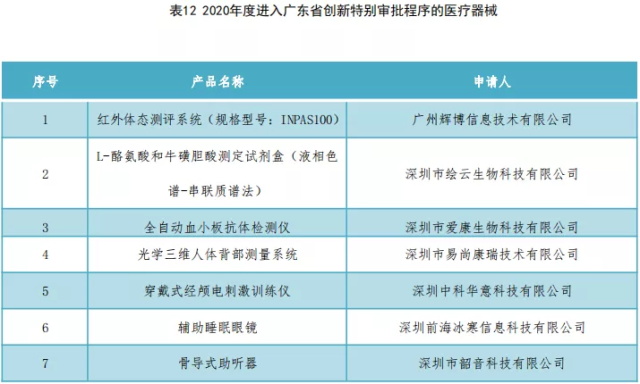
进入广东省药监局创新审批程序的医疗器械如表12所示。
2.2020年已批准上市创新医疗器械情况
2020年,国家药监局共批准境内23个创新医疗器械上市,各省份获批国家药监局创新特别审批程序的数量如图22所示。
文章来源于广东药监局,全文由奥咨达整理。奥咨达医疗是一家全球医疗器械产业服务商,提供专业的医疗器械注册服务,包括一类医疗器械注册、二类医疗器械注册、三类医疗器械注册等,欢迎咨询。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632