OLABS ∨
解决方案 ∨

由于新冠疫情影响,医疗器械产品进行CE认证的新法规MDR推迟1年即2021年5月26日实施,那现在欧盟委员会的筹备进展如何呢?
2021年4月1日欧盟委员会的官网上发布了医疗器械专家组的相关信息,确定了先建立依据欧盟委员会第2019/1396号决议而指定的12个领域的专家组,并公布了现有的专家组的名单以及后续招募的要求;同时确认专家实验室和欧盟参比实验室(EURL)将在稍后阶段建立。
该信息明确了专家组的任务,根据不同需求分为以下几个方面:
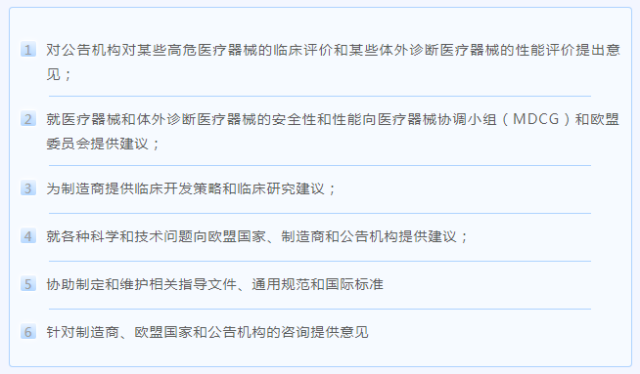
另外,在医疗器械符合性评估方面,依据公告机构的强制性咨询程序,专家组需要对符合临床评估咨询程序(CECP)的某些高风险医疗器械,以及符合性能评估咨询程序(PECP)的某些体外诊断医疗器械的咨询做出回应。两者都要求专家组评估符合这些程序的医疗器械的关键技术文件。根据需要,专家组还向欧盟委员会、MDCG、成员国、公告机构和制造商提供特别建议。
综上所述,广大制造商们可以通过与专家组的咨询获取关键技术文件,临床开发策略和临床研究的建议或意见。
奥咨达拥有全球化产业数据库、自主研发的RIMS医械合规管理软件、数百位行业领域专家分布在全球12家分公司,运营近2万㎡的科研创新中心和近30万㎡的生产基地,具有服务全球3000多家医械企业、取得全球1500余张注册证的经验和资源。
奥咨达在全球布局建设、运营医疗器械3C产业平台(CRO高端服务、CDMO先进制造、CMD医械云),打造医疗器械3C产业生态圈,为全球医械研发者、企业、园区、政府提供全方位、一站式的医疗器械产业解决方案。
新冠疫情期间,奥咨达助力商务部、中国医保商会建立中国医疗器械出口企业白名单审核体系。推出了新冠试剂欧洲快速通道一站式服务,涵盖专业人士使用新冠试剂和自测试剂,快速进入欧洲各国,优先采购,可在超市药店大规模销售。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632