OLABS ∨
解决方案 ∨
美国食品药品监督管理局(简称FDA)于8月5日发出正式公告,明显缩小了之前已发布的EUA申请适用范围。

EUA(即Emergency Use Authorization,紧急使用授权)为美国政府为缓解COVID-19新冠肺炎造成的外科口罩短缺而设立的绿色审批路径。
在最新的这一公告中提出,以下外科口罩将不再属于可获得EUA的范围:
(1)已被FDA批准的外科口罩;
(2)在中国生产的口罩;
(3)包含药物,生物制剂,纳米颗粒或抗菌/抗病毒剂的外科口罩。
并在其后给出满足条件的企业需提供的材料以及申请步骤。

此举之后,中国的外科口罩生产企业将再无法通过这一途径进入美国市场。面对突如其来的新冠肺炎疫情,正应是全世界合力抗疫的关键时刻,而这已经不是美国政府针对中国口罩生产商的第一次出尔反尔,想必中国企业对前不久FDA对于防护口罩的政策大变脸还历历在目。
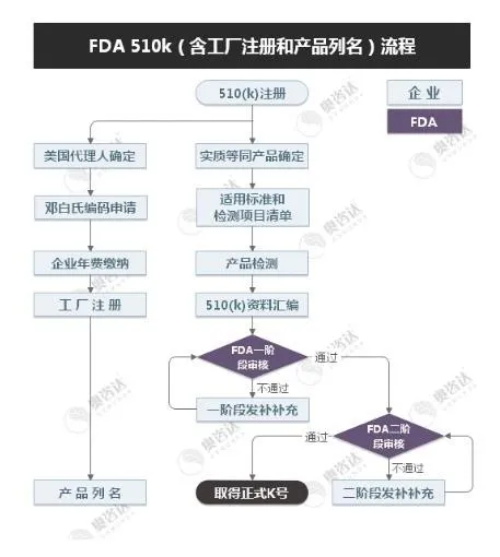
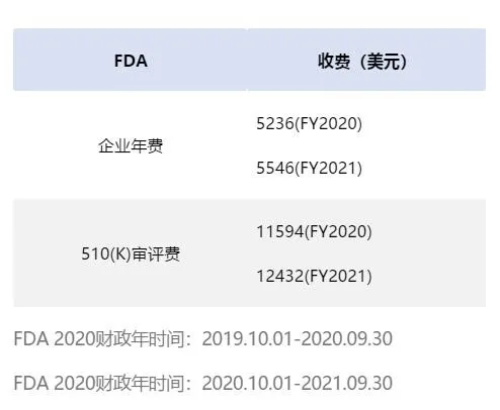
但是并非如此被动,中国的生产企业仍旧可以通过获批510(k)来进入美国市场,申请路径与费用信息详见下图:
奥咨达可为您提供医疗器械FDA 510(k)申请服务,以及医疗器械CRO等其他各项注册认证服务,如有需要,欢迎垂询!
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632