OLABS ∨
解决方案 ∨
为进一步推动浙江省的伦理审查及临床试验工作,发扬浙江精神,在省内进行有益的探索,浙江省临床试验伦理协作审查联盟应运而生。
由浙江省医学研究伦理管理办公室组织牵头,在杭十多家省级医疗单位联合发起,浙江省医学科技教育发展中心大力协助下,经前期的酝酿、讨论、准备,2020年4月30日,浙江省临床试验伦理协作审查联盟正式成立,现有联盟单位21家,共同发布了《浙江省临床试验伦理协作审查联盟共识》。
浙江省临床试验伦理协作审查联盟旨在达到三方面的目的,首先确保在现有法律、法规框架内规范伦理审查;其次,要确保各项伦理审查的质量,十一家发起单位的伦理委员会,管理严格、审查规范,承担伦理主审工作能够对审查工作带来示范效应,推动伦理审查的交流、合作,进一步促进全省其他机构审查质量和能力的提升;第三,提高伦理审查的效率,推动多中心临床试验项目伦理审查在浙江省内有序、快速、健康地开展。
浙江省临床试验伦理协作审查联盟共识
(第一版)
第一条 背景
在国家鼓励创新药物与器械研发以及创新改革临床试验管理的大背景下,为推动多中心临床试验伦理审查的一致性和及时性,提高伦理审查效率、避免重复审查,浙江省临床试验伦理协作审查联盟倡议省内药物临床试验机构伦理委员会实行协作审查机制。
第二条 宗旨与目的
浙江省临床试验伦理协作审查联盟组织业内专家共同制定“浙江省临床试验伦理协作审查联盟共识”(下称《共识》),旨在切实推动多中心临床试验伦理协作审查工作,提高效率,明确各方职责与权利,探索建立具体可行的操作规程。
第三条 适用范围
本着“试行探索、逐步完善”的原则,本《共识》适用于药物、医疗器械及诊断试剂的多中心注册临床试验,且项目在浙江省内有两家及以上参与单位的情况;暂不适用于药物上市后临床试验、研究者或行业组织发起的临床研究等。
第四条 发起单位、成员单位及轮值单位
(一)发起单位:是指在本联盟初次发起时,具备药物临床试验机构资格的相关单位自愿报名,遵守国家相关临床试验法律法规,遵守《共识》,经省医学研究伦理管理办公室(下称“办公室”)审核备案,其伦理委员会建设完备,运行规范,有能力承担主审工作的参与单位。后续成员单位在符合上述条件,自愿向轮值单位申请,经办公室审核备案后,可以转为“发起单位”;
(二)成员单位:是指在本联盟成立后,具备药物临床试验机构资格的相关单位自愿报名,遵守国家相关临床试验法律法规,遵守本《共识》,经省办公室审核备案的参与单位;
(三)轮值单位:联盟成立后,各发起单位自愿申请或推荐,经大会讨论选举后由其中一家发起单位承担,每轮时间为一年。后续以相同方式进行推荐下一轮轮值单位,可以连任,最长不超过三轮;
(四)“发起单位名单”、“成员单位名单”与“各专业主审-IRB名单”在办公室登记备案后,由当年轮值单位负责公布,并根据变化予以动态更新。
第五条 主审-IRB和副审-IRB
(一)主审-伦理委员会(IRB):是指对多中心临床试验项目的科学性与伦理性承担主要审查职责的伦理委员会,一般由符合条件的联盟发起单位的伦理委员会担任;
(二)副审-伦理委员会(IRB):是指在主审-IRB审查意见基础上,对多中心临床试验项目开展协作审查的伦理委员会,即除了主审-IRB以外的其他参与单位的伦理委员会。
第六条 主审-IRB的基本条件
(一)自愿加入浙江省临床试验伦理协作审查联盟的发起单位,并在办公室备案;
(二)药物临床试验机构在国家药品监督管理局(下称“NMPA”)网站上备案,或者国家临床医学研究中心及承担国家科技重大专项的临床试验机构;伦理委员会没有NMPA检查有效不良记录;
(三)机构与伦理委员会在过去6年中,未发生过关于临床试验及伦理审查方面的不良影响事件;
(四)主审-IRB承担主审项目工作时,必须有对应医学专业伦理委员或独立顾问;
(五)单位伦理委员会运行规范,定期开展内部或外部质量评估,并接受办公室的检查和质量评估。
第七条 伦理协作审查范围
(一)伦理协作审查共识适用于多中心临床试验项目的初始审查与修正案审查;
(二)对于主审-IRB通过的初始审查与修正案审查,副审-IRB可以要求对知情同意书进行本地化修改;
(三)年度/定期跟踪审查、严重不良事件审查、不依从/违背方案审查、提前终止试验审查与结题审查由各副审-IRB自行审查,必要时审查意见应及时与主审-IRB进行沟通。
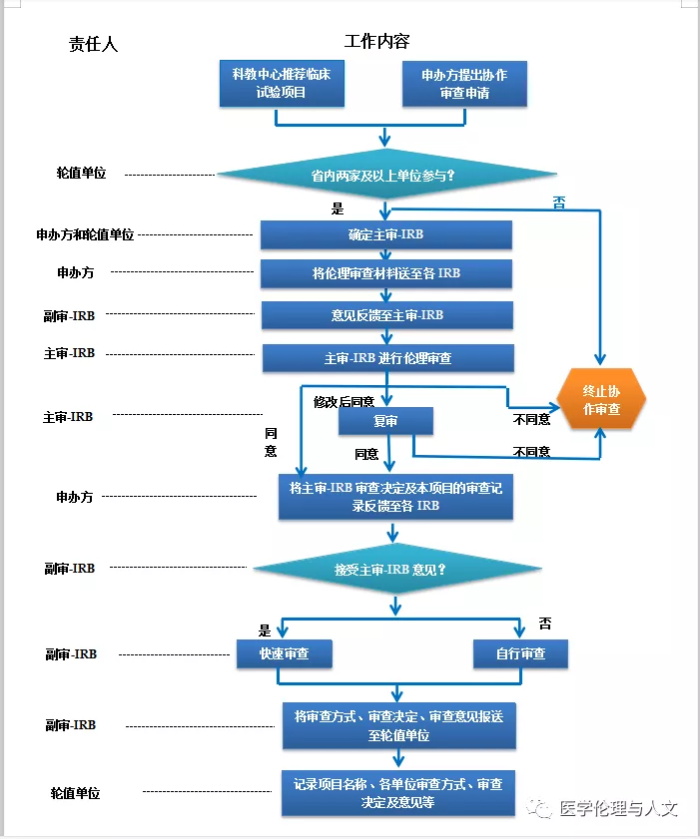
第八条 伦理协作审查程序
(一)组长单位伦理委员会符合主审-IRB条件,该伦理委员会即为本项目主审-IRB,省内各参加单位伦理委员会即为副审-IRB。如果组长单位伦理委员会不符合主审-IRB条件,则由申办方与组长单位伦理委员会协商解决;组长单位为非我省单位的,由申报方与轮值单位商定主审-IRB;
(二)申办方/CRO将临床试验方案、知情同意书和招募广告等伦理审查材料提前送至各参与单位的伦理委员会办公室。各参与单位一周内将伦理审查意见以书面的形式反馈至主审-IRB。必要时,主审-IRB牵头邀请联盟内各参与单位的伦理委员会通过钉钉在线讨论;
(三)主审-IRB在汇总各家参与单位伦理委员意见后,对临床试验项目的科学性和伦理性进行全面充分地审查,确保高质量规范的伦理审查,保证受试者尊严、安全和权益;主审-IRB应关注审查效率,原则上应在项目提交后22个工作日内完成初始审查并给出审查结论;
(四)对于通过主审-IRB审查的临床试验项目,申办者/CRO应及时将结果连同该项目的会议审查记录反馈给各副审-IRB;
(五)副审-IRB一般应认可主审-IRB的审查结论,在此基础上以快速审查的方式审查知情同意书及本机构可行性,包括研究者资格和能力、人员配备、设备条件等,建议在2周内完成;
(六)若不能接受主审-IRB审查意见,副审-IRB可再次进行会议审查,并将审查决定告知主审-IRB;
(七)主审-IRB和各副审-IRB之间应加强沟通,对于项目进行中发生的可能影响受试者安全、项目开展及其他可疑且非预期严重不良反应应及时通报。
第九条 权利与义务
(一)联盟各单位应该遵守本《共识》规定,共同推进多中心临床试验的伦理协作审查,在确保伦理审查规范的前提下,提高审查效率;
(二)联盟各单位伦理委员会应及时修定伦理审查SOP,将伦理协作审查纳入SOP中,规范伦理协作 审查程序;
(三)联盟各单位伦理委员会拥有对研究项目的以下决定权:同意、必要的修改后同意、不同意、终止或者暂停已同意的研究;
(四)对于接受主审-IRB审查意见的临床试验项目,其他参与项目单位及其伦理委员会保护本机构受试者的职责不变,此类临床试验项目相关责任最终由承担单位负责。项目开展过程中出现任何问题,如受试者损害补偿,项目承担单位及其伦理委员会的职责与处理程序不变;
(五)联盟各单位伦理委员会应不断改进工作,提高伦理审查水平的同质性;担任主审-IRB的伦理委员会应不断加强自身能力与规范化建设,切实履行保护多中心临床试验受试者的责任;
(六)认同本《共识》、并在本联盟若干单位中开展相关临床试验的申办方与CRO、SMO等公司,应加强与各参与单位的协调与沟通事项,促进协作审查工作进行;
(七)本联盟同时接收浙江省医学科技教育发展中心联系、推荐的多中心临床试验项目的伦理审查工作;各CRO、SMO等公司可以通过浙江省医学科技教育发展中心与各参与单位进行联系沟通,协调协作审查相关事宜。
第十条 退出原则
(一)联盟各单位遵循“参加自愿、退出有序”的原则。各单位签署“加入联盟确认书”长期有效,各单位因各种原因需要退出,应向办公室提出书面申请,经审核确认后可正式退出;
(二)办公室每两年对主审IRB审查质量进行一次评估,如果主审-IRB不能胜任多中心临床试验项目的主审职责,经发起单位大会讨论,可以将该伦理委员会从“主审-IRB名单”中移除,仅作为成员单位;同时接受主动请辞退出主审-IRB名单。
第十一条 附则
《共识》经浙江省临床试验伦理协作审查联盟大会讨论通过生效,日常事务及联系由联盟轮值单位伦理委员会负责,同时对本《共识》进行解释。
浙江省临床试验伦理协作审查联盟
2020年4月30日
临床试验伦理协作审查流程图
发起单位及成员


各专业主审-IRB




文章来源于医学伦理与人文 潇湘晨报,全文由奥咨达整理。了解更新医疗器械临床政策法规,请关注奥咨达动态或来电咨询。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632