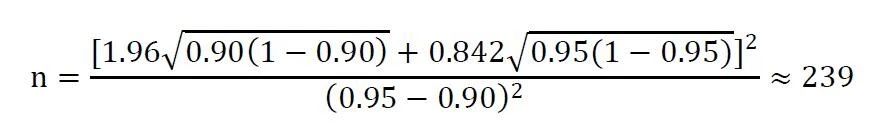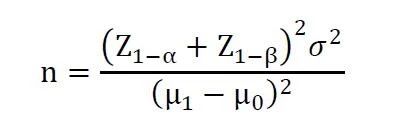样本量估算是临床试验设计中极其重要的环节,根据统计学原则确定的样本量,是预期检验假设能够得到确证所需的最小样本量。准确地估计样本量是临床试验得以有效进行的保证。随机对照试验设计是临床试验设计的金标准,在药物/医疗器械临床试验中被广泛采用,但在少数医疗器械临床试验中,由于伦理学原因、临床操作可行性或其他原因,很难进行随机对照的临床试验。此时,单组目标值临床试验可视为一种替代策略,为产品注册提供关键证据。本文将对医疗器械单组目标值试验样本量估算相关疑问进行解答。单组目标值临床试验中没有为试验组设立传统意义上的同期对照组,而是采用目标值作为理论对照值,将试验结果与理论值进行比较。但需注意试验设计时,为保证单组目标值法研究结果的科学性,使得当前试验所获得的结果与同类产品的外部对照具有可比性,需建立在特定的适应症、入选/排除标准、主要疗效评价指标及评价时间点等基础上。目标值应在研究方案设计阶段由申办方、临床研究者和统计学家共同制定,因目标值还将在试验结束后用来评价试验结果是否满足研究假设,故需在方案中详述目标值的确定依据。目标值确定常用方式有三种,但无论采用何种方法确定目标值,均建议事先与临床监管部门进行沟通,达成共识后方可开始临床试验。优先考虑监管部门指南中确定的目标值。如果该类产品指导原则中明确写明,可采用单组目标值法进行临床试验,且指南中对主要评价指标给出了明确的目标值。在此种情况下,可将指南推荐的目标值作为该产品临床试验主要评价指标的目标值。如果监管部门没有出台相关指导原则,则考虑行业标准或专家共识。即参考该产品所属专业领域公认的行业标准或公开发表的专家共识中给出的该产品主要评价指标所应达到的疗效或安全性水平,并以此水平作为目标值。可参考的行业标准包括但不限于ISO标准、国标、行标或部标等。上述两种情况均不适用时,则考虑同类产品历史研究结果的综合作为目标值确定依据。如具有可比性的同类产品所进行的临床试验结果的系统综述和meta分析结果。临床试验的样本量通常是依据对主要评价指标做出相应的假定后进行估计。方案中主要评价指标的含义、测量方法和时间点、计算方法都应当准确定义,在检索参考资料时应当注意主要指标定义是否与方案一致,避免出现“同名不同义”的情况。比如某方案的“治疗有效率”的评价时间点为干预后2周,随访时间越长治疗有效率越高,但是参考资料中同为“治疗有效率”但评价时间点为干预后3周,如果采用这个参考资料来估算样本量,可能会高估产品的疗效,在其他参数不变的情况下,计算出较少的样本量,最终可能因为把握度不足导致假设检验不成立。另外,还需要考虑参考资料产品的功能、性质等是否与本试验产品一致。大多数情况下主要评价指标一般只有一个,有些临床试验会设计两个或多个主要评价指标,此时需要注意假设检验的多重性问题,考虑调整参数α、β。检验水准:用α表示,也就是第Ⅰ类错误概率,常取单侧0.025。涉及多重性问题、期中分析时,会考虑对α进行调整。
检验效能:也叫把握度,用1-β表示,β代表第Ⅱ类错误概率。检验效能是指在设定的α基础上,原假设H0为假且检验结果拒绝了H0的概率。检验效能越高,发现差异的可能性越大,但同时所需样本量也越大。在临床试验中,检验效能不能低于80%。
脱落率:由以上公式估算出的样本量是在给定条件下满足临床试验所需的最小样本量。在实际试验过程中,由于不良反应、受试者依从性差等原因,会导致受试者脱落。因此,需要在样本量估计的基础上适度地扩大样本量以保证最终的有效样本量可以满足最小样本量的需求。脱落率通常不应超过20%,特殊情况需另外判断。

其中,Z1-α和Z1-β表示标准正态分布中对应的1-α和1-β的分位数。π1为被试产品主要评价指标的预期值,π0为目标值。例如,在一项单组目标值临床试验中,主要评价指标为有效率,根据相关参考文献,估计某试验产品预期有效率为95%,目标值为90%。设α=0.025(单侧),β=0.20,脱落率为20%,则该试验所需样本量为:
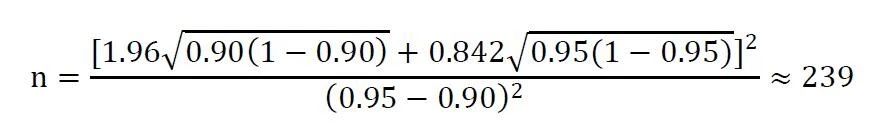
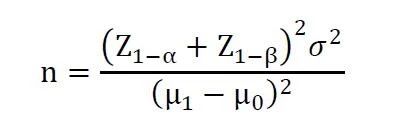
其中,Z1-α和Z1-β表示标准正态分布中对应的1-α和1-β的分位数。μ1为被试产品预期主要评价指标的总体均数,σ为主要评价指标的标准差,μ0为目标值。同上代入数据进行计算即可得出对应试验所需样本量。[1]陈峰,夏结来.临床试验统计学[M]. 人民卫生出版社, 2018.[2]王杨,胡泊,陈涛,et al.抽样调查法和单组目标值法对诊断试验样本量计算差异的分析[J].Chinese journal of Epidemiology,2010,31(12):1403-1405.
作者:奥咨达医疗器械服务集团 临床研究事业部